
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构式为:___________________________________。
(2)写出下列化合物官能团的名称:
B中含官能团名称________________;
D中含官能团名称________________。
(3)写出反应的化学方程式及反应类型:
①乙烯→B__________________;反应类型:________。
②B→C__________________;反应类型:________。
③B+D→乙酸乙酯_________________;反应类型:________。
【答案】![]() 羟基 羧基 CH2===CH2+H2O
羟基 羧基 CH2===CH2+H2O![]() CH3—CH2—OH 加成反应 2CH3CH2OH+O2
CH3—CH2—OH 加成反应 2CH3CH2OH+O2![]() 2CH3—CHO+2H2O 氧化反应 CH3CH2OH+ CH3COOH
2CH3—CHO+2H2O 氧化反应 CH3CH2OH+ CH3COOH ![]() CH3COO CH2 CH3 + H2O 取代或酯化反应
CH3COO CH2 CH3 + H2O 取代或酯化反应
【解析】
由图中的转化关系及反应条件可知,乙烯和水发生加成反应生B,则B为乙醇;B发生催化氧化生成C,则C为乙醛;B和D在浓硫酸的作用下生成乙酸乙酯,则D为乙酸。
(1)乙烯是共价化合物,其分子中存在C=C,其结构式为![]() 。
。
(2) B中含官能团为羟基;D中含官能团为羧基。
(3)写出反应的化学方程式及反应类型:
①乙烯→B的化学方程式为CH2===CH2+H2O![]() CH3—CH2—OH;反应类型:加成反应。
CH3—CH2—OH;反应类型:加成反应。
②B→C的化学方程式为2CH3CH2OH+O2![]() 2CH3—CHO+2H2O;反应类型:氧化反应。
2CH3—CHO+2H2O;反应类型:氧化反应。
③B+D→乙酸乙酯的化学方程式为CH3CH2OH+ CH3COOH ![]() CH3COO CH2 CH3 + H2O;反应类型:取代或酯化反应。
CH3COO CH2 CH3 + H2O;反应类型:取代或酯化反应。


科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大___________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率______________。(设溶液体积不变)
(2)另一学生也做同样的实验,由于反应太快,不好控制测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_________。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

①该反应的化学方程式是__________________________。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
A.X、Y、Z的反应速率相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对氯水成分和性质进行研究,实验如下:
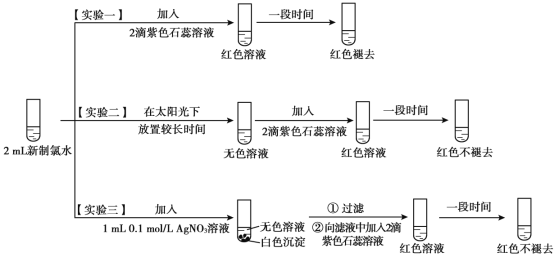
(1)氯水呈黄绿色,说明其中含有_________(填化学式)。
(2)实验一的现象表明,氯水具有酸性和_________性。
(3)氯气与水反应的化学方程式为__________。
(4)用化学用语说明实验二中“红色不褪去”的原因_______。
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。
(实验四)
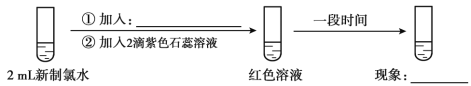
①加入:____________,现象:___________;
(6)进一步探究实验三中“红色不褪去”的原因。
(实验五)取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。写出氯水和硝酸银溶液反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ、在某一容积为5 L的体积不变的密闭容器内,加入 0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
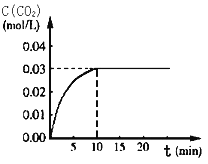
(1)根据图上数据,该温度(800℃)下的平衡常数K=________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有_____(填字母)
A.升高温度 B.降低温度 C.增大压强D.减小压强 E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,H2O的转化率_______(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2 )=c(H2)=0.13mol/L,则此时正、逆反应速率的大小:v正 _______ v逆 (填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为_____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量_____ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
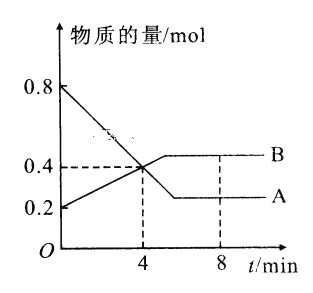
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
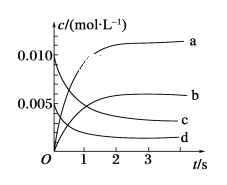
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补齐下列物质间的反应与对应反应类型的连线。
A. 从乙烯得到聚乙烯的反应 | a. 氧化反应 |
B. 乙醇与酸性重铬酸钾溶液反应 | b. 加聚反应 |
C. 乙烯与溴的四氯化碳溶液反应 | c. 取代反应 |
D. 乙酸和乙醇在浓硫酸作用下的反应 | d. 加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A. 以X浓度变化表示的反应速率为0.01mol/(L·s)
B. 将容器体积变为20L,Z的平衡浓度为原来的1/2
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com