
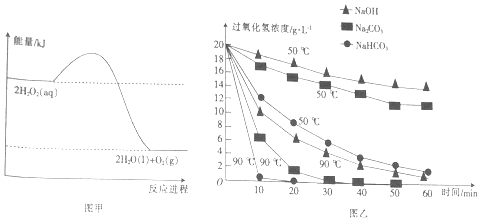
| A. | H2O2的分解反应为放热反应 | |
| B. | 断裂共价键所需的能量:2×E(O-O)<1×E(O=O) | |
| C. | 加入相同物质时,温度越高,H2O2分解的速率越快 | |
| D. | 相同温度下,加入不同物质的溶液,碱性越强,H2O2分解的速率越快 |
分析 A.由图形可知,反应物总能量大于生成物总能量;
B.H2O2分解反应属于放热反应,注意断裂化学键吸收能量,形成化学键放出能量;
C.升高温度,可加快反应速率.
D.可根据曲线斜率变化判断.
解答 解:A.由图形可知,反应物总能量大于生成物总能量,则为放热反应,故A正确;
B.H2O2分解反应属于放热反应,注意断裂化学键吸收能量,形成化学键放出能量,反应物、生成物含有相同的O-H,则2×E(O-O)<1×E(O=O),故B正确;
C.升高温度,可加快反应速率,故C正确;
D.由图象可知在90℃时一定时间之内,碳酸氢钠的斜率较大,则反应较快,故D错误;
故选D.
点评 本题综合考查化学平衡的影响以及反应热与焓变,为高频考点,侧重于学生的分析能力的考查,注意把握图象曲线的变化,难度不大.


科目:高中化学 来源: 题型:解答题
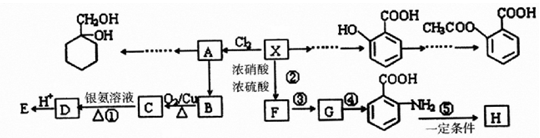
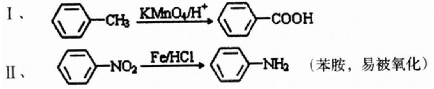
 ;
;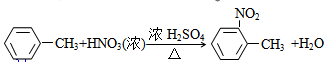 ;
;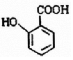 有多种同分异构体,写出符合下列条件的所有结构简式:
有多种同分异构体,写出符合下列条件的所有结构简式: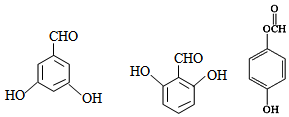 ;
;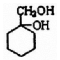 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)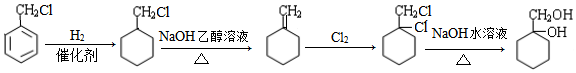 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中滴加氯水Fe2++Cl2═Fe3++2C1- | |
| B. | NaHCO3溶液水解:HCO3-+H2O?CO32-+H3O+ | |
| C. | 等体积、等浓度的稀氢氧化钡溶液与稀碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O | |
| D. | 少量CO2通人苯酚钠溶液中:2C6H5O-+CO2+H2O═2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
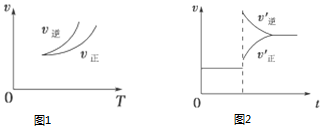
| A. | 图1说明正反应为吸热反应 | |
| B. | 反应达平衡后,增大压强气体密度将减小 | |
| C. | 图2可表示升高温度使平衡向逆反应方向移动 | |
| D. | 图2虚线可表示使用催化剂后引发的反应速率变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素有浓度、压强、温度和催化剂 | |
| C. | 可逆反应达到化学平衡时,正、逆反应的速率都不为0 | |
| D. | 增大反应物浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不含CH4和H2,可能含有NO2和NH3 | |
| B. | 一定含有CO,可能含HCl和CO2 | |
| C. | 只含有CO和HCl | |
| D. | 一定含CO和HCl,可能含CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑧⑤⑦ | B. | ③②⑧①⑤⑦ | C. | ④⑤⑧⑥⑦① | D. | ①③⑧⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com