

分析 (1)Ni原子核外电子数为28,根据能量最低原理书写最外层电子排布式;
(2)①A.甲烷中C原子形成4个σ键,反应后二氧化碳分子中C原子形成2个σ键,均没有孤对电子;
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形;
C.同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于氧元素的;
D.B原子一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键;
②化合物(HB=NH)3的结构与苯的类似;
(3)立方氮化硼结构和硬度都与金刚石相似,均为原子晶体,键长越短,键能越大,熔点越高;晶体中B、N原子配位数均为4;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,利用均摊法计算每个B原子连接O原子数目,进而确定多硼酸根离子符号;
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键;
(5)根据图片知,每个氧化镍所占的面积=(2×a×10-10m)×(2×a×10-10m×sin60°),每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)Ni原子核外电子数为28,最外层电子排布式4s2,
故答案为:4s2;
(2)①A.由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同周期随原子序数增大,第一电离能呈增大趋势,ⅡA族、ⅤA族元素第一电离能共有同周期相邻元素,故所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.B原子一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确.
故选:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键,B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个,
故答案为:12;
(3)立方氮化硼结构和硬度都与金刚石相似,均为原子晶体,B-N键键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低;晶体中B、N原子配位数均为4,涂“●”和画“×”分别标明B与N的相对位置为: ,
,
故答案为:B-N键键长大于C-C键,键能小于C-C键,导致立方氮化硼熔点比金刚石低; ;
;
(4)1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,则每个B原子实际结合O原子数目为1+2×$\frac{1}{2}$=2,代一个单位负电荷,故多硼酸根化学式为:[BO2]nn-(或BO2-),
硼砂晶体中存在形成2个σ键、3个σ键的B原子,B原子最外层电子数全部处于成键,故B原子采取sp2、sp3杂化,
故答案为:[BO2]nn-(或BO2-);sp2、sp3;
(5)根据图片知,每个氧化镍所占的面积=(2×a×10-12m)×(2×a×10-12m×sin60°)=2$\sqrt{3}$a2×10-24m2,则每平方米含有的氧化镍个数=$\frac{1}{2\sqrt{3}{a}^{2}×1{0}^{-24}}$,每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,
所以每平方米含有的氧化镍质量=$\frac{74.7}{{N}_{A}}$g×=$\frac{1}{2\sqrt{3}{a}^{2}×1{0}^{-24}}$=$\frac{24.9\sqrt{3}×1{0}^{25}}{2{a}^{2}{N}_{A}}$g,
故答案为:$\frac{24.9\sqrt{3}×1{0}^{25}}{2{a}^{2}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间结构、化学键、杂化轨道、晶体结构与计算等,(5)中注意计算“1NiO”的体积应包含孔隙体积,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液一定呈酸性 | |
| B. | pH=7的溶液一定呈中性 | |
| C. | c(OH-)═c(H+)的溶液一定呈中性 | |
| D. | 水中加入硫酸恢复至室温后,Kw=c(H+)•c(OH-)将变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试剂W
试剂W .
.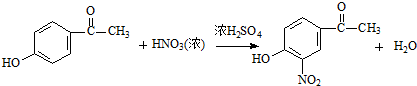 .
.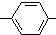 CH2
CH2 N=C=O生成高聚物的结构简式
N=C=O生成高聚物的结构简式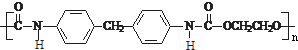 .
. -CH2CH2N(C2H5)2(无机试剂任用)
-CH2CH2N(C2H5)2(无机试剂任用) 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
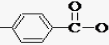
| A. | 化合物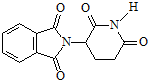 的分子式为C13H9O4N2 的分子式为C13H9O4N2 | |
| B. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| C. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 | |
| D. | 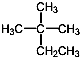 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用乙醚从黄花蒿中提取青蒿素 | |
| B. | 用浸有酸性高锰酸钾的硅藻土作水果保鲜剂 | |
| C. | 生石灰用作煤炭燃烧的固硫剂 | |
| D. | 服用阿司匹林出现水杨酸反应时用小苏打解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐中阴离子的结构示意图为  | |
| B. | 氧化亚铁溶于足量稀硝酸的离子方程式:FeO+2H+=Fe2++H2O | |
| C. | NaHS水解的离子方程式:HS-十H20?H3O++S2- | |
| D. | 用惰性电极电解氯化钠溶液,阳极电极反应式:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
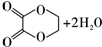 ,B的结构简式为OGC-CHO.
,B的结构简式为OGC-CHO.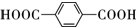
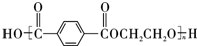 .
.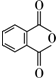 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O═H2SO4+2HI | ||
| C. | H2O2+H2SO4═SO2+O2↑+H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com