
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| B. | 稀盐酸和硅酸钠溶液反应:SiO32-+2H+═H2SiO3↓ | |
| C. | 碳酸钙和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ |
分析 A.HCl完全电离;
B.反应生成硅酸和氯化钠;
C.碳酸钙在离子反应中保留化学式;
D.电子、电荷不守恒.
解答 解:A.氧化锰和浓盐酸反应的离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,故A错误;
B.稀盐酸和硅酸钠溶液反应的离子反应为SiO32-+2H+═H2SiO3↓,故B正确;
C.碳酸钙和稀盐酸反应的离子反应为CaCO3+2H+═CO2↑+H2O+Ca2+,故C错误;
D.铜和氯化铁溶液反应的离子反应为2Fe3++Cu═2Fe2++Cu2+,故D错误;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重于学生的分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
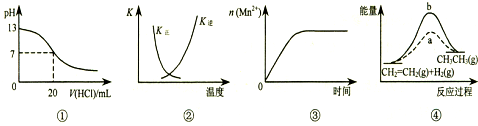
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
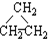
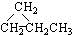
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;GCO(NH2)2.
;GCO(NH2)2.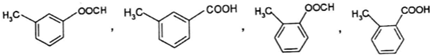 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com