
| 选项 | X | Y | Z |
| A | Al | NaOH(aq) | CuO(s) |
| B | Fe3O4 | HNO3(aq) | HI(aq) |
| C | Mg | NaOH(aq) | HCl(aq) |
| D | NaOH(aq) | AlCl3(aq) | HNO3(aq) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al与强碱溶液反应生成氢气,Al与CuO反应生成Cu;
B. Fe3O4与HNO3反应不生成单质;
C.Mg与氢氧化钠溶液不反应;
D.NaOH与AlCl3、HNO3发生复分解反应.
解答 解:A.Al与NaOH溶液反应生成氢气,在加热条件下,Al与CuO反应置换反应生成Cu,所以两个反应都发生氧化还原反应,且都有单质生成,故A正确;
B. Fe3O4与HNO3反应不生成单质,生成硝酸铁、NO和水,故B错误;
C.Mg与氢氧化钠溶液不反应,Mg与HCl反应生成氢气,故C错误;
D.NaOH与AlCl3、HNO3发生复分解反应,不发生氧化还原反应,故D错误.
故选A.
点评 本题考查了氧化还原反应,题目难度不大,侧重于考查氧化还原反应的判断和元素化合物的性质,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把煤块变成煤粉燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应制H2时加入少量CuSO4溶液而使反应速率加快 | |
| C. | 固态FeCl3和固态NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 双氧水中加入少量MnO2,即可迅速放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的HCl、Na2CO3、CH3COOH的混合溶液 | |
| B. | 0.01mol•L-1的盐酸和pH=12的氢氧化钡溶液等体积混合 | |
| C. | 0.05mol•L-1的H2SO4溶液和0.1mol•L-1的KOH溶液等体积混合 | |
| D. | 非电解质溶于水得到的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | mg该原子中含有aNA个原子 | |
| C. | mg该原子的物质的量一定是$\frac{m}{a{N}_{A}}$mol | |
| D. | 阿伏加德罗常数NA=$\frac{12}{α}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
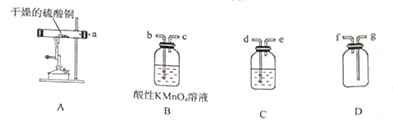 CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.
CuSO4•5H2O是铜的重要化合物,有着广泛的应用.硫酸铜在高温下分解可得到SO2、SO3、O2和Cu2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol•L-1 硝酸/mL | 硝酸铜 溶液/mL | 亚硝酸钠 溶液/mL | 水的体积 /mL | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 0.5 | 实验①和②探究Cu2+对实验的影响;实验①和③探究亚硝酸根的影响. |
| ② | 5 | 20 | 0.5 | 0 | 0 | |
| ③ | 5 | 20 | 0 | X | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2 mol/LNH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:c(NH4+)>c (NO3-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c (Na+)+c(H+)=c (CH3COO-)+c (OH-)+c (CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g CH3+含有的电子数为NA | |
| B. | 在lL 0.lmol/L氯化铝溶液中阳离子总数大于0.lNA | |
| C. | 标准状况下,11.2L四氯化碳中含有的C-CI键的个数为2NA | |
| D. | 60g SiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com