
【题目】硫酸在下列反应中,只起催化作用的是( )
①乙酸和乙醇的酯化反应
②苯的硝化反应
③油脂的水解反应
④淀粉的水解反应
A. ①④
B. ②④
C. ③④
D. ①③
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】ClO2作为新一代饮用水的消毒剂,正逐渐代替Cl2来进行自来水的消毒。请回答下列问题:
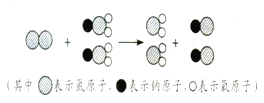
(1)ClO2的名称为 ;
(2)ClO2中氯元素的化合价为 ;
(3)ClO2所属物质类别是 ;
(4)以下微观过程表示制取ClO2的反应 原理,分析以上微观模拟图,你能得出的结论是: 。(写一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有一个羟基的化合物A 10 g,与乙酸反应生成乙酸某酯11.85 g,并回收了未反应的A1.3 g,则A 的相对分子质量约为
A. 98 B. 116 C. 158 D. 278
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方成式方程式正确的是( )
A.用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3-
B.用强碱溶液吸收工业制取硝酸尾气NO+NO2+2OH-=2NO3-+H2O
C.用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D.向AlCl3溶液中滴加过量的氨水:Al3++4NH3·H2O=AlO2-+2H2O的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个反应:
①Fe+H2SO4(稀)===FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
试回答下列问题:
(1)反应①中________(填元素符号)被氧化,还原产物为________;反应②中________作还原剂,________元素被还原。
(2)当反应①生成2 g H2时,消耗H2SO4的质量是________ g。
(3)反应②中生成32 g SO2气体时,消耗H2SO4的质量是________ g,其中有________ g H2SO4被还原,转移电子________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.标准状况下2.24LCO2通入1molL-1100![]() 氢氧化钠溶液中:CO2+OH-=HCO3-
氢氧化钠溶液中:CO2+OH-=HCO3-
B.硝酸铝溶液中加入过量氨水Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.Na2S水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。
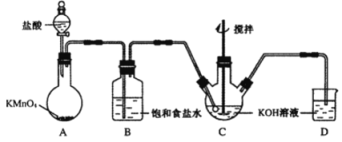
查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的作用是 。
(3)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是 。
(4)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式 ;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是 。
(5)制得的粗产品中含有Fe(OH)3、KCl等杂质。提纯方案:将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,用砂芯漏斗(硬质高硼玻璃)过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式) 、 ,过滤时不用普通漏斗而采用砂芯漏斗的原因是(用离子方程式说明) 。
②晶体用乙醇洗涤的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气根据成分不同分为贫气和富气,贫气中甲烷的含量较多,富气中乙烷、丙烷、丁烷的含量相对高一些。若要将它们液化,下列说法正确的是( )
A.贫气易液化 B.富气易液化
C.二者液化条件相同 D.减压降温均有利于两者液化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com