
| A. | 溶液pH值从大到小的是③>②>①>④ | |
| B. | c(H2S) 从大到小是①>④>②>③ | |
| C. | 在H2S 和NaHS混合液中:2c(Na+)═c(H2S)+c(HS-)+c(S2-) | |
| D. | 在NaHS溶液中:c(H+)+c(Na+)═c(OH-)+c(HS-)+c(S2-) |
分析 ①H2S,硫化氢在溶液中部分电离出氢离子,溶液显示酸性;
②NaHS溶液中,硫氢根离子的电离程度需要水解程度,溶液显示碱性;
③Na2S溶液中硫离子水解,溶液显示碱性,且硫离子水解程度大于硫氢根离子,溶液的pH大于②;
④H2S和NaHS混合液,硫化氢的电离程度大于硫氢根离子的水解,溶液显示酸性,由于硫氢根离子抑制了硫化氢的电离,则溶液酸性小于①,
A.据此判断溶液的pH;
B.上述分析可知c(H2S)大小;
C.溶液中的各种溶质的物质的量量浓度均为0.1mol•L-1 ,在H2S 和NaHS混合液中存在物料守恒;
D.结合溶液中电荷守恒分析判断,阴阳离子所带电荷数相同.
解答 解:A.①H2S、④H2S和NaHS的溶液显示酸性,溶液中pH<7,由于④中硫氢根离子抑制了硫化氢的电离,则④中氢离子浓度小于①,则溶液的pH:①<④,②NaHS和NaHS、③Na2S的溶液显示碱性,由于酸性硫化氢大于硫氢根离子,则③的水解程度大于②,所以溶液的pH:③>②,故四种溶液的pH从大到小的顺序为:③>②>④>①,故A错误;
B.①H2S、④H2S和NaHS中存在大量硫化氢分子,且硫化氢的电离程度越大,则硫化氢浓度越小,则硫化氢浓度大小为:①<④;
②NaHS、③Na2S二者溶液中硫化氢浓度减小,硫氢根离子水解生成硫化氢,则②中数据生成的硫化氢浓度大于③,
所以四种溶液中硫化氢浓度大小为:④>①>②>③,故B错误;
C.在H2S 和NaHS混合液中存在物料守恒,溶液中的各种溶质的物质的量量浓度均为0.1mol•L-1 ,2c(Na+)═c(H2S)+c(HS-)+c(S2-),故C正确;
D.在NaHS溶液中存在电荷守恒:c(H+)+c(Na+)═c(OH-)+c(HS-)+2c(S2-),故D错误;
故选C.
点评 本题考查了溶液中离子浓度大小比较、盐的水解原理及其影响、电解质溶液中物料守恒和电荷守恒分析,题目难度中等,注意掌握盐的水解原理及其影响因素,明确判断溶液中离子浓度大小常用方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 将40g NaOH溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 从100mL 10mol•L-1的浓盐酸中取出10mL | |
| D. | 20g NaOH溶解在水中配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
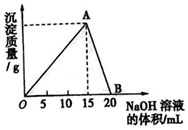 向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴加到蔗糖中搅拌 | 固体变黑膨胀 | 浓硫酸有吸水性 |
| B | 将盐酸缓缓滴入Na2CO3溶液中 | 无气泡产生 | 二者不反应 |
| C | 向某溶液中加入浓NaOH溶液并加热,在试管口用湿润红色石蕊纸检验 | 试纸变蓝 | 原溶液中含有NH4+ |
| D | 向氢氧化铁胶体中滴加氯化铵饱和溶液 | 产生沉淀 | 沉淀为FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
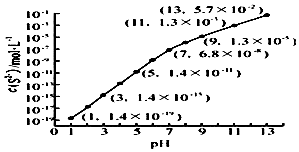 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义. .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
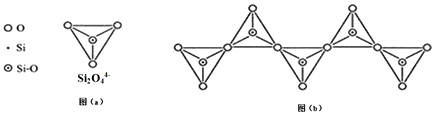
| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 主要现象 | 结论 |
| A | 将在酒精灯灼烧后的铜丝迅速插入无水乙醇中 | 铜丝变黑 | CH3CH2OH发生氧化反应生成CH3COOH,铜丝起催化作用 |
| B | 分别在苯和乙醇中滴加酸性高锰酸钾溶液 | 紫红色都褪去 | 苯和乙醇都有还原性 |
| C | 分别在水、乙醇中 加入钠粒 | 都产生气体 | 产生的气体为氢气 |
| D | 将酒精在空气中点燃 | 产生无色火焰 | 酒精发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com