
以下现象与电化学腐蚀无关的是 ( )。
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
科目:高中化学 来源: 题型:
(1)水中的重金属污染物主要包括 、 、 、 等,它们能在生物体内 ,不易排出体外,故危害很大。水中的重金属污染物可以通过水中的 ,浓度逐级加大,而人正处于 ,通过食物或饮水,将这些重金属摄入体内,引起人体急性或慢性中毒。
(2)写出水中的无机汞(如HgCl2)在微生物作用下转化为甲基氯化汞的化
学方程式________________________________________________________。
蛋白质水解的产物NH3在微生物作用下,进一步氧化为 ,进而氧化
为 ,其过程用化学方程式表示为 ,
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水是人类最宝贵的资源,我国是淡水资源最贫乏的国家之一,节约用水已成为全国人民的共识。下列不符合节约用水的做法是 ( )。
A.农田普及滴灌技术
B.鼓励超量开采地下水,以补充城市水资源紧缺
C.工厂废水经处理用于城市绿化或农业灌溉
D.减少污染源,保护水源地不被污染
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
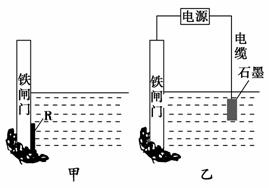
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为_________
_______________________________________________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中
焊接在铁闸门上的固体材料R可以采用 ( )。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直
流电源的________极。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,将x mL pH=a的稀NaOH溶液与y mL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入醋酸、浓硫酸、稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Q1kJ、Q2kJ、Q3kJ。则三者的由小到大关系是________(用Q1、Q2、Q3表示)。
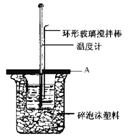 (2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是____________________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值 (填偏大、偏小、无影响)
(2)如图所示A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其目的是____________________________; 若实验中不加盖泡沫塑料板,则求得的中和热数值 (填偏大、偏小、无影响)
(3)实验室用50mL 0.50mol·L-1盐酸、50mL 0.55mol·L-1NaOH溶液利用上图装置,进行测定中和热的实验。假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸的温度 B.反应前盐酸的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.4 |
| 2 | 20.2 | 20.4 | 23.6 |
| 3 | 20.5 | 20.6 | 23.8 |
依据该学生的实验数据计算,该实验测得的中和热ΔH为________。(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com