
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
科目:高中化学 来源: 题型:
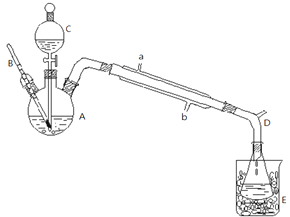
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| HBr,过氧化物 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 140℃ |
| 名称 | 相分子质量 | 密度 g/mL | 熔点 ℃ | 沸点 ℃ | 溶解度:g/100mL溶剂 | ||
| 水 | 醇 | 醚 | |||||
| 浓H2SO4 | 98.00 | 1.84 | 10.35 | 340 | |||
| 乙醚 | 74.00 | 0.71 | -89.12 | 34.5 | 能溶 | 混溶 | 混溶 |
| 乙醇 | 46.00 | 0.780 | -114.5 | 78.4 | ∞ | ∞ | ∞ |
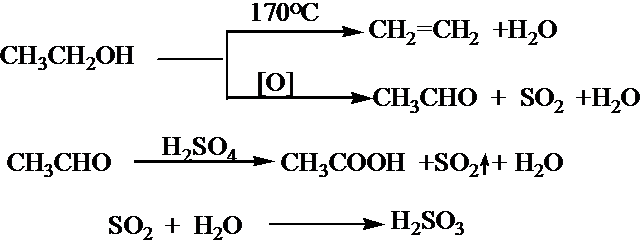
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molA+1molB |
| B、1molC+1molD |
| C、2molC+2molD |
| D、0.5molA+0.5molB+0.5molC+1molD |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若在移液过程中,溶液溅出容量瓶,则应重新配制溶液 |
| B、将5.85gNaCl固体溶于1 L水中可配成0.1 mol?L-1的NaCl溶液 |
| C、固体直接转移到容量瓶中,并加水稀释到刻度线 |
| D、称量时,将固体NaCl直接放在天平左盘上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com