
 某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 水浴 |
| 水浴 |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| A、10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子 |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D、一定温度下,1 L 0.50 mol?L-1NH4Cl溶液与2 L 0.25mol?L-1NH4Cl溶液含NH4+物质的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
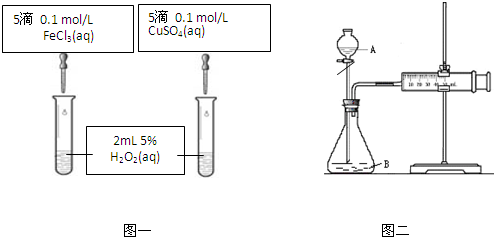
| 1 |
| 2 |
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3 mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
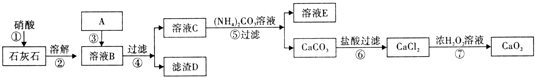
查看答案和解析>>
科目:高中化学 来源: 题型:
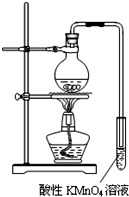 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液Y中铝元素的存在形式 | 溶液X中 | ||
| 一定存在的离子 | 一定不存在的离子 | 不能确定的离子 | |
| Al3+ | |||
| Cl- | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- |
| B、c(Fe3+)=0.1mol/L的溶液中:NH4+、AlO2-、SO42-、HCO3- |
| C、水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- |
| D、c(H+)=1×10-13mol/L的溶液中:K+、Cl-、AlO2-、CO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com