
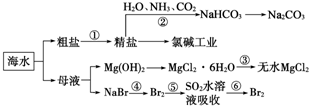
| A. | 过程①中除去粗盐中的SO${\;}_{4}^{2-}$、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 过程②中应先通入NH3再通入CO2气体 | |
| C. | 过程③中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| D. | 从第⑤~⑥步的目的是浓缩、富集溴单质 |
分析 A.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
B.二氧化碳与水反应形成不稳定的碳酸,致使水吸收二氧化碳量较少,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收;
C.氯化镁中的镁离子能水解,酸性环境会抑制水解,MgCl2•6H20要在HCl氛围中加热脱水制得无水MgCl2;
D.根据图示制取流程分析知⑤~⑥的目的是浓缩、富集溴单质.
解答 解:A.镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,故A错误;
B.二氧化碳与水反应形成不稳定的碳酸,致使水吸收二氧化碳量较少,氨气在水中的溶解度大于二氧化碳,先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,所以过程②中应先通入NH3再通入CO2气体,故B正确;
C.在过程③中的MgCl2•6H2O灼烧过程中镁离子易水解生成氢氧化镁,在氯化氢气体中脱水可以抑制镁离子水解,故C正确;
D.第⑤步将溴单质被还原为溴离子,第⑥步中溴离子被氧化为溴单质,过程的目的是浓缩,目的是浓缩、富集溴单质,故D正确;
故选A.
点评 本题考查了海水资源的综合应用,涉及物质的分离提纯等知识,侧重于化学与生活的综合运用,培养了学生运用知识分析问题的能力.难点是除杂过程中加入药品的先后顺序,要根据物质的特点来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1mol的-OH与1mol的OH-所含电子数均为10NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为6NA | |
| D. | Na2O2的反应中,每生成0.1molO2,转移电子数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
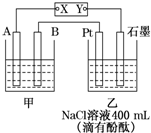 如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热的反应不必加热就能发生 | |
| B. | 化学反应一定有能量变化 | |
| C. | 吸热反应发生过程中必须加热 | |
| D. | 化学反应热效应数值与反应物的多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据②③④可确定一定含有NO2-、CO32-、Cl-三种阴离子 | |
| B. | 由②中的实验现象可推测一定含有NO2- | |
| C. | 不能确定是否一定含有NO3- | |
| D. | 由④即可确定一定不存在SO42-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com