
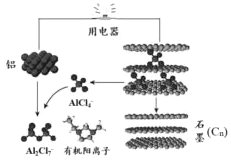
 2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示.下列说法不正确的是( )| A. | 充电时的阳极反应为:Cn+AlCl4--e-=CnAlCl4 | |
| B. | 放电时,铝为负极、石墨为正极 | |
| C. | 放电时,有机阳离子向铝电极方向移动 | |
| D. | 放电时的负极反应为:Al-3e-+7AlCl4-=4Al2Cl7- |
分析 A、充电时的阳极失电子发生氧化反应;
B、放电时,铝是活泼的金属铝是负极,不活泼石墨为正极;
C、原电池中阳离子向正极移动;
D、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-.
解答 解:A、充电时的阳极失电子氧化反应,电极反应式为:Cn+AlCl4--e-═CnAlCl4,故A正确;
B、放电时,铝是活泼的金属铝是负极,不活泼石墨为正极,故B正确;
C、原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,故C错误;
D、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故D正确;
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,属于综合知识的考查,难度中等.


 阅读快车系列答案
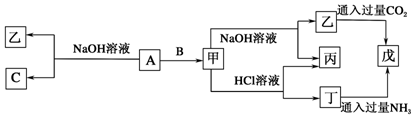
阅读快车系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.
2016年11月3日20点43分,中国首枚重型运载火箭“长征五号”在海南文昌航天发射场顺利点火升空.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
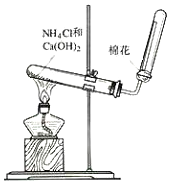
| A. | 收集方法是向下排空气法 | |
| B. | 将湿润的蓝色石蕊试纸放在试管口处验满 | |
| C. | 试管口的棉花可防止氨气与空气形成对流,利于收集氨气 | |
| D. | 实验结束后将蘸有稀硫酸的棉花放在导管口吸收剩余氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.
工业上常用电解氯化亚铁的方法获得氧化剂,吸收有毒的气体.某小组同学欲探究1 mol/L FeCl2溶液的电解产物.| 序号 | 实验装置 | 阳极实验现象 | 阴极 |
| 实验Ⅰ | 电压1.5V电解1 mol/L FeCl2溶液,pH=4.9 | 阳极表面没有气泡生成;阳极附近溶液逐渐变浑浊,颜色变成黄绿色;最终石墨电极表面附有少量红褐色固体. | 没有观察到气泡生成,铜电极表面有银灰色金属光泽的固体析出. |
| 实验序号 | pH | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅱ | 2.4 | 无 | 未变色 | 黄绿色,少量浑浊 | 无 | 有 |
| 实验Ⅲ | -0.4 | 无 | 未变色 | 黄绿色,无浑浊 | 有 | 无 |
| 实验序号 | 电压 (V) | 阳极 | 阴极 | |||
| 是否有气泡产生 | 湿润淀粉碘化钾试纸是否变蓝 | 电极附近溶液颜色变化 | 是否有气泡产生 | 电极表面是否出现镀层 | ||
| 实验Ⅳ | 3 | 无 | 未变色 | 缓慢变成黄绿色,有浑浊 | 少量 | 有,约1min |
| 实验Ⅴ | 6 | 少量 | 变蓝 | 很快变成黄绿色,有浑浊 | 大量 | 有,迅速 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
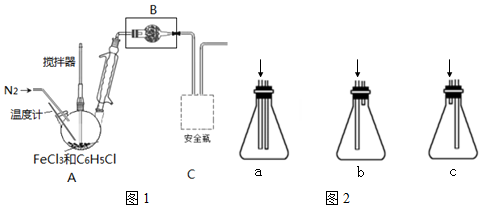
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com