
A.“浮法”玻璃 B.石英玻璃 C.钢化玻璃 D.光学玻璃
科目:高中化学 来源: 题型:阅读理解
 高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程:
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
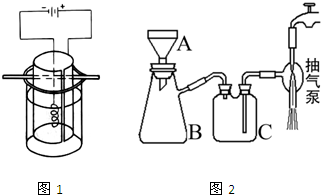
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com