
在下列给定条件的溶液中,一定能大量共存的离子组是
A.加水稀释C(OH?)/C(H+)增大的溶液:K+、Na+、SO42-、[Al(OH)4]-
B.常温下Kw/c(H+)=0.1 mol/L的溶液:K+、Na+、SiO32-、NO3-
C.铁片加入产生气泡的溶液:Na+、NH4+、I-、NO3-
D.NaHCO3溶液:K+、Na+、SO42-、Al3+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①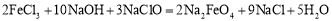
②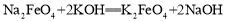 。下列说法不正确的是
。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
通常用于衡量一个国家石油化工发展水平的标志是
A、石油的产量 B、乙烯的产量 C、天然气的产量 D、硫酸的产量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O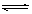 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列实验操作与预期实验目的或实验结论一致的是
选项 | 实验操作及现象 | 实验目的或结论 |
A | 测同浓度的Na2CO3、CH3COONa 溶液的PH值前者大 | 酸性强弱:CH3COOH 比H2CO3强 |
B | 向Na2SiO3溶液中通入CO2 出现浑浊 | 非金属性强弱:C>Si |
C | 向某溶液加入盐酸酸化的氯化钡溶液有沉淀产生 | 说明此溶液中一定含SO42? |
D | 比较H2O和H2S的沸点前者大 | 非金属性:O>S |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) 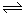 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 500 | 600 | 800 | 900 | 1000 |
K | 0.5 | 0.6 | 1.0 | 1.3 | 1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为 ,达到平衡后,CO2的转化率为 。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤ C.⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铍遇冷水剧烈反应 |
| B、氧化铍的化学式为Be2O3 |
| C、氢氧化铍能与氢氧化钠溶液反应 |
| D、氯化铍水溶液显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com