
【题目】将一定质量的镁铝合金全部溶解在200mL盐酸中(体积变化不计),取10mL反应后的溶液,用1mol/LNaOH溶液滴定得下图关系。

(1)求Mg、Al的质量各是多少?
(2)求盐酸的物质的量浓度为多少?
【答案】1.44g;1.08g;1.4mol/L
【解析】镁铝合金溶解在盐酸中转化为氯化镁、氯化铝,然后加入氢氧化钠溶液,根据图像可知开始阶段没有沉淀产生,说明盐酸过量,沉淀达到最大值后过量的氢氧化钠溶解氢氧化铝,最终的沉淀是氢氧化镁,结合图像分析解答。
(1)由图像可判断10mL溶液中铝离子、镁离子全部沉淀用去氢氧化钠溶液的体积是14mL-2mL=12mL,物质的量是0.012L×1mol/L=0.012mo;而随后氢氧化铝溶解用去了2mL氢氧化钠,物质的量是0.002mol,由Al(OH)3+OH-=AlO2-+2H2O可知生成的氢氧化铝是0.002mol,根据铝原子守恒可知原合金中金属铝的物质的量是0.002mol×200mL/10mL=0.04mol,质量是0.04mol×27g/mol=1.08g;根据Al3++3OH-=Al(OH)3↓可知生成0.002mol氢氧化铝消耗氢氧化钠是0.006mol,则沉淀镁离子消耗氢氧化钠是0.012mol-0.006mol=0.006mol,所以根据Mg2++2OH-=Mg(OH)2↓可知镁离子的物质的量是0.003mol,因此根据镁原子守恒可知原合金中金属镁的物质的量是0.003mol×200mL/10mL=0.06mol,质量是0.06mol×24g/mol=1.44g;
(2)当NaOH滴至14mL时,镁铝全部沉淀,溶液中的溶质全部为NaCl,根据Cl原子守恒,即得n(HCl)=n(NaCl)=n(NaOH)=0.014mol,所以c(HCl)=0.014mol÷0.01L=1.4mol/L。


科目:高中化学 来源: 题型:
【题目】
化合物H 是一种仿生高聚物(![]() )的单体。由化合物A(C4H8)制备H的一种合成路 线如下 :
)的单体。由化合物A(C4H8)制备H的一种合成路 线如下 :
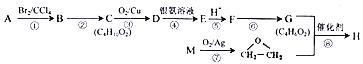
已知: A 与M 互为同系物。回答下列问题:
(1) A的系统命名为_____________。F分子中含有的官能团名称为__________________。
(2) B→C的反应条件为______________________。反应③、⑥的反应类型分别为_________、_________。
(3) 反应⑧的化学方程式为___________________________________。
(4) 化合物X 为H 的同分异构体,X 能与新制的氢氧化铜悬浊液反应生成砖红色沉淀,还能与Na2CO3饱和溶液反应放出气体,其核磁共振氢谱有4 种峰。写出两种符合要求的X 的结构简式________________。
(5) 根据上述合成中的信息,试推写出以乙烯为原料经三步制备CH3-COOCH=CH2的合成路线__________(其他试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2与NO2的下列说法正确的是
A. 都能引起光化学烟雾 B. 都能使石蕊试液先变红后褪色
C. 都是酸性氧化物 D. 都能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国卫生组织经过考察和研究,认为我国使用的铁锅是有益于人类健康的理想炊具,并向全世界推广,其主要原因是( )
A.价格便宜,不易生锈B.有银白色金属光泽,导电性好
C.烹调的食物中留有人体需要的铁元素D.传热慢,保温性能好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置,测定工业纯碱(含有少量NaCl)中Na2CO3的含量.
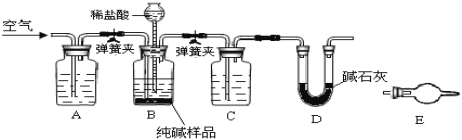
(1)检验装置B气密性:塞紧三孔橡胶塞,夹紧弹簧夹,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若________________,说明装置不漏气.
(2)装置A的作用是____,装置C中的试剂为___.
(3)某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?____(选填“必要”或“不必要”),判断的理由是____________________.
(4)实验前称取28.80g样品,实验后D装置增重8.80g,则样品中Na2CO3质量分数为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2 + H2O![]() H+ + Cl-+HClO
H+ + Cl-+HClO
B. CaCO3加入醋酸中:CO![]() + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O ![]() H2↑+ Cl2↑ +2OH-
H2↑+ Cl2↑ +2OH-
D. 酸性KMnO4溶液滴入FeSO4溶液中:MnO![]() + Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L多巴胺是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下
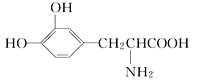
下列关于L多巴胺的叙述不正确的是( )
A. 它属于α氨基酸,既具有酸性,又具有碱性
B. 它遇到FeCl3溶液显紫色
C. 它可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D. 它既与酸反应又与碱反应,等物质的量的L多巴胺最多消耗NaOH与HCl的物质的量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。已知: ClO2浓度过高或受热易分解,甚至会爆炸。现有下列制备ClO2的方法:
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因__________。
(2)方法二:氯化钠电解法
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,氯化钠电解槽中发生反应的化学方程式为_____________。
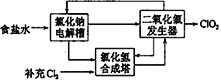
(3)方法三:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:____________________;
②与电解法相比,用草酸还原法制备ClO2的特点是____________________,提高了生产、储存及运输过程的安全性。
(4)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3 反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。
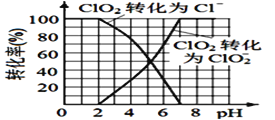
用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:
①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH________。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3 溶液滴定至终点,消耗Na2S2O3 溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为________mol/L( 用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com