
下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | D | G | |||||
| 3 | E | C | H | |||||
| 4 | F | I |
(1)写出相应元素符号:A: E: G: H: 。
(2)第ⅠA中碱性最强的物质是 (化学式);第ⅦA族中最高价氧化物对应水化物酸性最强的是
(化学式)。
(3)写出C的单质与NaOH溶液反应的离子方程式: 。
(4)写出H的单质置换出I的离子方程式: 。
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
在一定条件下MO3-与M-发生反应;MO3-+5M-+6H+ == 3M2+3H2O,则下列关于M元素的叙述中正确的是
A.M位于元素周期表的第VA族 B.M的氢化物的水溶液呈酸性
C.MO3-中的M元素只能被还原 D.M2在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不能按 (“→”表示一步完成)关系转化的是
(“→”表示一步完成)关系转化的是
| 选项 | A | B | C | D |
| a | NaOH | HNO3 | HCl | S |
| b | Na2CO3 | NO | Cl2 | SO3 |
| c | NaCl | NO2 | HClO | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知镁跟稀硝酸反应时,每有1molHNO3反应,就有0.8mol电子转移,此时HNO3的还原产物可能是
A.NO2 B.NO C.N2O D.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系 (部分产物略去)。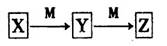
上述转化中X可能是下列物质中的
①S单质 ②AlCl3 ③NaOH ④NH3
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程如下图所示:

请回答下列问题:
(1)工艺流程中多次用到“过滤”操作,过滤操作中用到的玻璃仪器有 。
(2)实验过程中先“氨化”,后“碳酸化”,理由是 。
(3)工业纯碱含有少量碳酸氢钠,某兴趣小组为测定某工业纯碱中碳酸钠的质量分数,设计了下列实验方案:
方案一:分别称量干燥坩埚(m1g)和纯碱样品的质量(m2g),将纯碱样品放人坩埚中充分加热。将坩埚置于干燥器中冷却后称量,重复“加热、冷却、称量”操作多次后,最终称量坩埚和剩余样品的总质量为m3g,则样品中纯碱的质量分数为
 (用含m1、m2、m3的代数式表示)
(用含m1、m2、m3的代数式表示)
方案二:正确称取样品w g,用右图装置进行实验。
①装置C中试剂是 。
②E装置的作用是 ,若不连接E装置所测Na2CO3的质量分数 (填“偏大”、“偏小”或“无影响”)。
③反应前通入N2,反应后继续通人N2的目的是 。
(4)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知:酸性H2CO3>HClO>HCO3-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
 | |||
 | |||
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.图8所知反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C.若在图7所示的平衡状态下,再向体系中充入He,此时v正>v逆
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某有机物的结构为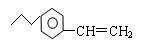 ,请完成下列问题:
,请完成下列问题:
(1)该有机物的分子式为 ;1mol该有机物完全燃烧需要消耗 mol氧气;
(2)写出该有机物与溴的四氯化碳溶液反应的化学方程式 ;
(3)该有机物与氢气完全反应,需要消耗 mol氢气。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com