
分析 (1)根据n=$\frac{m}{M}$计算硫酸钠物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(2)溶液是均一的,取出溶液浓度与原溶液浓度相等,根据n=cV计算硫酸钠物质的量,再根据m=nM计算硫酸钠的质量;
(2)根据稀释定律计算.
解答 解:(1)14.2g无水Na2SO4的物质的量=$\frac{14.2g}{142g/mol}$=0.1mol,溶于水配成500mL溶液,则溶液物质的量浓度为$\frac{0.1mol}{0.5L}$=0.2mol/L,
答:溶液物质的量浓度为0.2mol/L;
(2)溶液是均一的,取出溶液浓度与原溶液浓度相等,其中含溶质的质量为0.05L×0.2mol/L×142g/mol=1.42g,
答:含有硫酸钠的质量为1.42g;
(2)根据稀释定律,稀释前后溶质的物质的量不变,则稀释后溶液物质的量浓度为$\frac{0.05L×0.2mol/L}{0.1L}$=0.1mol/L,
答:稀释后溶液物质的量浓度为0.1mol/L.
点评 本题考查物质的量浓度有关计算,比较基础,注意对物质的量浓度定义式的理解与灵活应用.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.4mol/L | D. | 0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只需加热 | B. | 水、氢氧化钠溶液、加热蒸发 | ||
| C. | 水、盐酸、加热蒸发 | D. | 水、氢氧化钙、过滤、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的纯碱溶液清除灶具上的油污 | |
| B. | 用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ | |
| C. | 用硫酸清洗锅炉中的水垢 | |
| D. | 用明矾[KAl(SO4)2•12H2O]作净水剂,除去水中悬浮的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
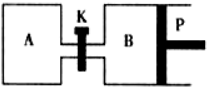 甲醇可以与水蒸气反应生成氢气,反应方程式如下:
甲醇可以与水蒸气反应生成氢气,反应方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
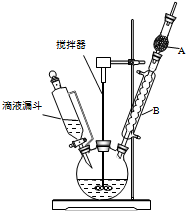 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇[ | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NH4+、I-、Fe3+ | B. | K+、Ag+、Cl-、NO3- | ||
| C. | ClO-、Fe2+、SO42-、Na+ | D. | Ba2+、Na+、OH-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com