
根据下列热化学方程式
(1)C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol
(2)H2(g)+O2(g)═H2O(l)△H2=﹣285.8kJ/mol
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | △H=﹣488.3 kJ/mol | B. | △H=+244.1 kJ/mol |
|
| C. | △H=﹣996.6 kJ/mol | D. | △H=+996.6 kJ/mol |
| 用盖斯定律进行有关反应热的计算.. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | 依据热化学方程式和盖斯定律计算分析,反应的焓变与反应过程无关,只与起始状态和终了状态有关. |
| 解答: | 解:(1)C(s)+O2(g)═CO2 (g)△H1=﹣393.5kJ/mol (2)H2(g)+O2(g)═H2O(l)△H2=﹣285.8kJ/mol(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=﹣870.3kJ/mol 依据盖斯定律(1)×2﹣(3)+(2)×2得到 2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=﹣488.3 kJ/mol 故选A. |
| 点评: | 本题考查热化学方程式的书写和盖斯定律的计算应用,题目较简单. |


科目:高中化学 来源: 题型:
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉 淀。下列判断合理的是 ( )
淀。下列判断合理的是 ( )
A.一定有Cl- B.一定有SO42- C.一定没有Al3+ D.一定没有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32—、SO32—、SO42—、C1—、NO2-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:
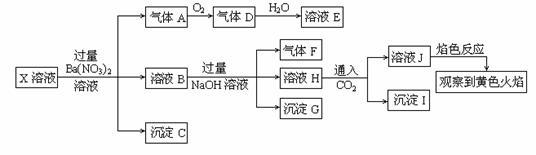
下列结论正确的是
A.X中肯定存在Na+、Fe2+、A13+、NH4+、SO42—
B.气体F经催化氧化可直接生成气体D
C.沉淀C一定是BaSO4、 沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D.X中不能确定的离子是 A13+ 、Na+、K+和C1—
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是( )
|
| A. | 元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据 |
|
| B. | OH﹣与H3O+组成元素相同,所含质子数相同 |
|
| C. | 结构示意图为 |
|
| D. | H、D、T具有相同的质子数,是氢元素的三种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列相关离子方程式书写正确的是( )
|
| A. | NaClO溶液与FeCl2溶液混合:6Fe2++3ClO﹣+3H2O═2Fe(OH)3↓+3Cl﹣+4Fe3+ |
|
| B. | 用食醋检验牙膏中的碳酸钙:CaCO3+2H+═Ca2++CO2↑+H2O |
|
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O |
|
| D. | 电解MgCl2水溶液的离子方程式:2Cl﹣+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | ﹣2 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣4 | ﹣1 |
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 .
(2)A、B、C、E的简单氢化物稳定性顺序是 (用化学式回答).
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是 .
(4)请写出B的单质的一种重要用途: ;工业上制取该单质的原理反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2﹣、Cl﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl﹣、I﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2•8H2O与NH4Cl的反应均既为氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物.
|
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl–、SO42–、CO32–、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子 B.Cl– 一定存在,且c(Cl–)≥0.4mol/L
C.SO42–、NH4+一定存在,Cl–可能不存在 D.CO32–、Al3+一定不存在,K+可能存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com