
设NA为阿伏伽德罗常数 的数值。下列说法正确的是
的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
科目:高中化学 来源: 题型:
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、C、D的化学式:B________、C________、D________。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO42- 、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3- 、NO3-
C.0. 1 mol·L-1AgNO3 溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2 溶液: H+、Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=13的无色溶液中,可以大量共存的一组离子是 ( )
A.NH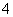 、NO
、NO 、K+、SO
、K+、SO
B.CO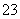 、NO
、NO 、HCO
、HCO 、Na+
、Na+
C.Na+、ClO-、AlO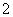 、NO
、NO
D.Cu2+、K+、Na+、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
B.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
C. 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1 NA
D. 1 mol的羟基与1 moL的氢氧根离子所含电子数均为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol氨基(—NH2)中含有10NA个电子
B.标准状况下,2.24 L18O2中含有2NA个中子
C.标准状况下,22.4 L C8H18中含有25NA个共价键
D.在反应CaO+3C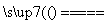 CaC2+CO↑中,每生成1 mol CO,转移3NA个电子
CaC2+CO↑中,每生成1 mol CO,转移3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
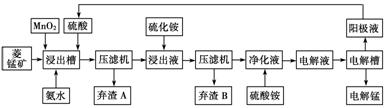
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2[来源:全,品…中&高*考+网] |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。[来源:全,品…中&高*考+网]
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com