
分析 (1)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中恰好完全反应生成碳酸钠,根据碳酸钠溶液中碳酸根离子水解判断离子浓度大小;
①根据碳酸钠溶液中的质子守恒书写;
②根据碳酸钠溶液中的电荷守恒书写;
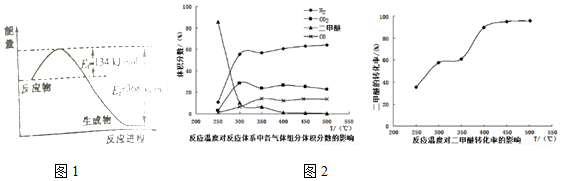
(2)根据能量变化图,反应热等于=正反应的活化能减去逆反应的活化能,结合热化学方程式的书写规则书写;
(3)A.因Ni是固体,改变用量对反应物的转化率无影响;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变;
C.根据外界条件和该反应本身的特点进行分析;
D.根据不同物质的速率关系判断可逆反应时,应当一正一逆,速率之比等于系数比;
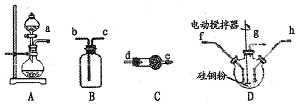
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO.
解答 解:(1)标准状况下,1.12L CO2的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,氢氧化钠的物质的量为:1mol•L-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2O?HCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO-3)>c(H+);
①碳酸钠溶液中,水电离出的氢离子部分与CO32-结合生成H2CO3和HCO3-,溶液中质子守恒:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
故答案为:c(HCO3-)+c(H+);
②碳酸钠溶液中,电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:2c(CO32-)+c(HCO3-)+c(OH-);
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol-1;
(3)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;
B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;
C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;
D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;
故答案为:C;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,
故答案为:C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2?3H2+3CO,
故答案为:可能发生另一种制氢反应为CH3OCH3+CO2?3H2+3CO.
点评 本题考查较为综合,涉及盖斯定律的应用、化学平衡常数、平衡状态的判断、图表信息的提取等,综合性强,侧重分析与应用能力的综合考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料的大量开发和使用是导致温室效应和形成酸雨的重要原因 | |
| B. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| C. | 为了确保食品安全,应禁止使用食品添加剂 | |
| D. | 为了提高农作物产量,应该大量使用农药和化肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
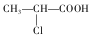 +HCl
+HCl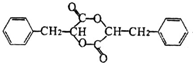 .
.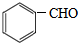 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$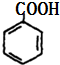 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.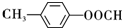 .
.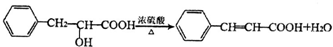 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 实验操作 | 预测的实验现象 |
| B | 向Na2CO3溶液中滴加盐酸 | 立即有气体逸出 |
| C | 将浓硫酸滴加到盛有铜片的试管中,并将蘸有品红溶液的试纸置于试管口 | 试纸褪色 |
| D | 铅箔在酒精灯火焰上加热 | 铝熔化但不会滴下 |
| 向淀粉的水解液中加入新制Cu(OH)2悬浊液并加热 | 一定有砖红色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
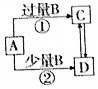
| A. | 若A为AlCl3溶液,B 可能为氨水,反应①的离子方程式为Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 若A为Fe,B可能为稀HNO3,反应②的离子方程式为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴定C、D 溶液中的阴离子 | |
| D. | 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2、CO均为酸性氧化物 | |
| B. | 水玻璃、明矾、漂白粉都是强电解质 | |
| C. | 煤油、“乙醇汽油”“生物柴油”都是碳氢化合物 | |
| D. | 纳米铁粉去除水体中的Hg2+和植物油酸败都是发生了氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.5 L | B. | 12.3 L | C. | 15.7 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com