
| A. | 糖类和蛋白质都属于高分子化合物 | B. | 苯和聚乙烯均能发生加成反应 | ||
| C. | C5H11Cl有6种同分异构体 | D. | 石油分馏、煤干馏都可得到烃 |
分析 A.高分子化合物的相对分子质量一般在10000以上;
B.聚乙烯不含碳碳双键;
C.先确定C5H12的同分异构体:正戊烷、异戊烷和新戊烷,然后根据各有机物的结构简式及等效H原子分别判断正戊烷、异戊烷和新戊烷中含有的一氯代物种类即可;
D.石油分馏可得到不同沸点的烃,煤干馏可得到芳香烃.
解答 解:A.糖类中的单糖、二糖不是高分子化合物,故A错误;
B.聚乙烯不含碳碳双键,不能发生加成反应,故B错误;
C.主链有5个碳原子的一氯代物为:CH3CH2CH2CH2CH2Cl、CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3;
主链有4个碳原子的一氯代物为:CH3CH(CH3)CH2CH2Cl、CH3CH(CH3)CHClCH3、CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;
主链有3个碳原子的一氯代物为:CH2C(CH3)2CH2Cl,
根据分析可知,C5H11Cl的同分异构体总共有8种,故C错误;
D.石油为多种烃的混合物,分馏可得到不同沸点的烃,煤干馏可得到芳香烃等,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,侧重考查学生的分析能力,把握常见有机物的结构、官能团、性质及反应类型为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1(反应热) | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
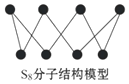
| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
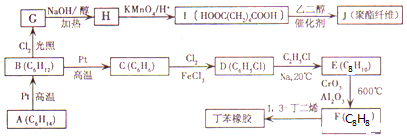
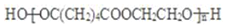 .
.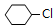 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$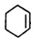 +NaCl+H2O.
+NaCl+H2O.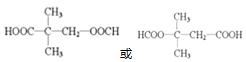 (写出其中一种的结构简式).
(写出其中一种的结构简式).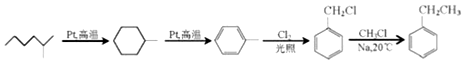 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com