
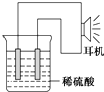
 乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白: 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题
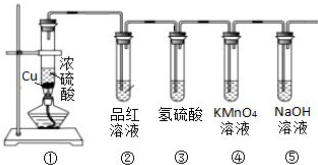
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为296×10-3mol•L-1•s-1 | |
| B. | 该温度下的反应平衡时N2O5的转化率为29.6% | |
| C. | 1000s后,其它条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,则c(N2O5)<5.00mol/L | |
| D. | 反应达平衡后,其他条件不变,升高温度平衡常数将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可以提高CO的转化率 | |
| B. | 加入催化剂能提高CO的转化率 | |
| C. | 缩小反应器容积可以使平衡正向移动 | |
| D. | 再充入适量H2,该反应平衡常数的数值会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验不需要指示剂 | |
| B. | 用量筒量取上述硫酸的体积 | |
| C. | H2SO4的浓度为1.00 mol•L-1 | |
| D. | 参加反应的H+和OH-的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
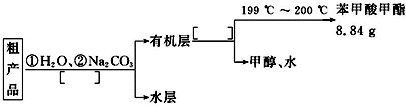
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热小于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com