
| A. | ①② | B. | ③ | C. | ④ | D. | 均不符合 |
分析 反应热为57.3kJ/mol是强酸和强碱的稀溶液反应生成1mol水放出的热量,依据概念分析判断.
解答 解:①H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)反应是稀硫酸和氢氧化钠溶液反应生成2mol水,放热114.6KJ,故①不符合;
②H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)反应是稀硫酸和氢氧化钡反应生成硫酸钡沉淀放热,生成2mol水反应放热大于114.6KJ,故②不符合;
③NH3•H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l)反应是弱碱和强酸反应生成1mol水,弱电解质电离吸热,所以反应放热小于57.3kJ,故③不符合;
④NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) 反应是弱酸和强碱反应生成1mol水,弱电解质电离是吸热过程,反应放热小于57.3kJ,故④不符合;
故选D.
点评 本题考查了中和热的概念理解和分析判断,关键是掌握中和热概念,弱电解质电离吸热,生成沉淀放热,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节是-CH2-CH2-CH2- | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
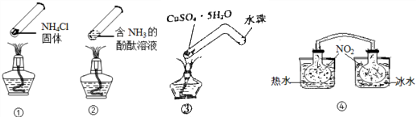
| A. | 加热时,①上部汇集了固体NH4Cl,说明NH4Cl易升华 | |
| B. | 加热时,②溶液颜色变,冷却后又恢复为原来的颜色 | |
| C. | 加热时,③中固体由蓝色变为白色,冷却后又恢复为原来的颜色 | |
| D. | ④中,浸泡在热水中的容器内气体颜色变深,说明受热时反应2NO2?N2O4向正方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有0.6NA个K+ | |
| B. | 1L溶液中含有K+和SO42-总数为0.9NA | |
| C. | 取出10mL该溶液中,K+浓度为0.3mol/L | |
| D. | 100mL溶液中含有SO42-数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 常温常压下,1.06gNaCO3含有的分子数目为0.02NA | |
| D. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |


| 时间(min) 浓度(mol/L-1) | 0min | 10min | 20min | 30min | 40min | 50min |
| NO(mol/L-1) | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com