
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
分析 A.金属性越强,对应最高价氧化物水化物的碱性越强;
B.非金属性越强,对应最高价氧化物水化物的酸性越强;
C.非金属性越强,对应氢化物的还原性越弱;
D.电子层越多,原子半径越大;同周期原子序数大的原子半径小.
解答 解:A.金属性Na>Mg>Al,则碱性Al(OH)3、Mg(OH)2、NaOH从左到右依次递增,故A不选;
B.非金属性Cl>S>P,则酸性HClO4、H2SO4、H3PO4从左到右依次递减,故B选;
C.非金属性Cl>Br>I,则还原性HCl、HBr、HI从左到右依次递增,故C不选;
D.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径为Na>S>O,故D不选;
故选B.
点评 本题考查周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
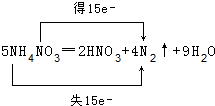 ;5:3.
;5:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 50% | C. | 66.7% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液中:Rb+、Cs+、CH3COO-、Br- | B. | 饱和溴水中 I-、NO3-、Na+、SO32- | ||
| C. | D+、Cl-、NO3-、SiO32- | D. | Ag+、Fe3+、Br-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

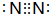 ;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
;并写出由b生成c的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1735Cl与1737Cl得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 | |
| B. | CN-中C元素显+2价,N元素显-3价,则非金属性N>C | |
| C. | 氰化钠是一种重要的化工原料,也是剧毒危险品,皮肤伤口接触、吸入、吞食微量可中毒死亡 | |
| D. | 电石属于危化品中的遇湿易燃固体,需贴上右图标志,其着火时不能用水灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com