

分析 含铝、铁、铜的合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,B中加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,铁离子易水解,可通过调节溶液pH的方法得到氢氧化铁沉淀,即E为氢氧化铁,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,
(1)滤渣B为铁和铜,B中加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,加入的物质能消耗氢离子,但是不能引入新的杂质;
(3)根据Ksp[Fe(OH)3]和溶液中氢氧根离子的浓度计算c(Fe3+);
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,根据物质的量关系写方程式;
(5)根据反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O进行判断.
解答 解:含铝、铁、铜的合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,B中加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,铁离子易水解,可通过调节溶液pH的方法得到氢氧化铁沉淀,即E为氢氧化铁,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,
(1)滤渣B为铁和铜,B中加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,反应的离子方程式为NO3-+Fe+4H+=Fe3++NO↑+2H2O,2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O;
故答案为:NO3-+Fe+4H+=Fe3++NO↑+2H2O;2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO、碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,
故答案为:CD;
(3)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=4.0×10-8mol/L;
故答案:4.0×10-8;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,则反应时铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,其离子方程式为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O;
故答案为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O;
(5)n(HNO3)=0.1L×2mol/L=0.2mol,n(H2SO4)=0.1L×3mol/L=0.3mol,
则n(H+)=0.2mol+2×0.3mol=0.8mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,
由反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,0.3mol完全反应生成0.3mol硫酸铜,则c(CuSO4)=$\frac{0.3mol}{0.1L}$=0.3mol/L;
故答案为:0.3mol/L.
点评 本题主要考查了物质的分离提纯和制备,题目涉及离子反应方程式的书写、除杂质、氧化还原反应、溶度积的有关计算等,综合性较强,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:解答题
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
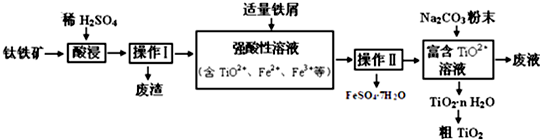
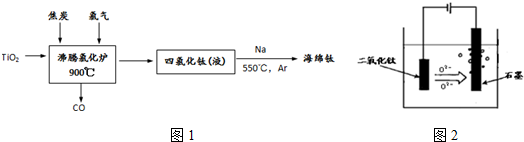
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
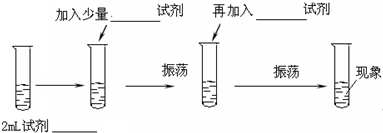
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度过高对合成氨不利 | |
| B. | 合成氨在高压下进行是有利的 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 增加N2的浓度可提高平衡混合物中NH3的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向被污染的土壤洒石灰 | |
| B. | 向远离污染源的高处撤离 | |
| C. | 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离 | |
| D. | 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com