
(1)碳酸钾溶液蒸干得到的固体物质是___________________________________________,
原因是________________________________________________________________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是__________,原因是_______________。
(3)FeCl2溶液蒸干灼烧得到的固体物质是__________,原因是______________________。
(4)碳酸氢钠溶液蒸干灼烧得到的固体物质是________,原因是_________________________
________________________________________________________________________。
(5)亚硫酸钠溶液蒸干灼烧得到的固体物质是________,原因是__________________。
答案 (1)K2CO3 尽管加热过程促进水解,但生成的KHCO3和KOH反应后又生成K2CO3
(2)KAl(SO4)2·12H2O 尽管Al3+水解,但由于H2SO4为难挥发性酸,最后仍然为结晶水合物。注意温度过高,会脱去结晶水
(3)Fe2O3 Fe2+水解生成Fe(OH)2和HCl,在加热蒸干过程中HCl挥发,Fe(OH)2逐渐被氧化生成Fe(OH)3,Fe(OH)3灼烧分解生成Fe2O3
(4)Na2CO3 2NaHCO3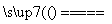 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)Na2SO4 2Na2SO3+O2===2Na2SO4
解析 本题涉及的知识范围较广,除了盐的水解外,还应考虑到盐的热稳定性、还原性等。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
第四周期中,未成对电子数最多的元素是__________。(填名称)
(1)它位于第________族。
(2)核外电子排布式是________。
(3)它有________个能层,________个能级,__________种运动状态不同的电子。
(4)价电子排布式________,价电子排布图__________。
(5)属于________区。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关共价键的叙述中,不正确的是( )
A.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数
B.水分子内氧原子结合的电子数已经达到饱和,故一般不能再结合其他氢原子
C.非金属元素原子之间形成的化合物也可能是离子化合物
D.所有简单离子的核电荷数与其核外电子数一定不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
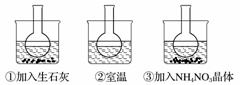
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为__________________________
(用离子方程式和必要文字解释)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________(填字母)。
A.水解反应为放热反应
B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量
D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____________、____________、____________。(填“左”、“右”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的作用时,涉及如下反应:
2NO2(g)+NaCl(s)??NaNO3(s)+ClNO(g) K1
ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)??2ClNO(g) K2
ΔH2<0 (Ⅱ)
实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO )、c(NO
)、c(NO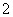 )和c(CH3COO-)由大到小的顺序为________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1)
)和c(CH3COO-)由大到小的顺序为________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数K1(H2Y)>K(HX)>K2(H2Y),则下列叙述不正确的是( )
A.物质的量浓度相同时,各溶液的pH关系为pH(Na2Y)>pH(NaX)>pH(NaHY)
B.a mol·L-1 HX溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(X-),则不一定a<b
C.在HX溶液中滴入Na2Y溶液,反应2HX+Y2-===2X-+H2Y成立
D.若0.1 mol·L-1 NaHY溶液呈酸性,则其水解能力小于电离能力
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.FeCl3溶液与Cu的反应:Cu+Fe3+===Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O===2NO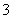 +NO+2H+
+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO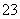
查看答案和解析>>
科目:高中化学 来源: 题型:
A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气。A不溶于NaOH溶液,而B能溶于NaOH溶液。B能使适量溴水褪色,并产生白色沉淀,而A不能。B苯环上的一溴代物有两种结构。
(1)写出A和B的结构简式:A___________________,B____________________。
(2)写出B与NaOH溶液发生反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)A与金属钠反应的化学方程式为_______________________________________
________________________________________________________________________;
与足量金属钠反应生成等量H2,分别需A、B、H2O三种物质的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com