
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
![]()
A. 若D是一种强碱,则A、B、C均可与X反应生成D
B. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
【答案】D
【解析】
A.若D是一种强碱,A为Na、E为氧气、B为氧化钠、C为过氧化钠、X为水、D为氢氧化钠;
B.若D是一种强酸,如为硝酸,则A为N2或NH3,B为NO,C为NO2,E为O2,X为H2O;
C.若D为NaCl,A为氢氧化钠、E为二氧化碳、B为碳酸钠、C为碳酸氢钠、X为盐酸;
D.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2,X为NaOH,C为Fe2+,B为Fe3+,A为Cl2,E为Fe。
A.若D是一种强碱,A为Na、E为O2、B为Na2O、C为Na2O2、X为H2O、D为NaOH,符合转化关系,Na、Na2O、Na2O2都能与水反应,A正确;
B.若D是一种强酸,如为HNO3,则A为N2或NH3,E为O2,B为NO,C为NO2, X为H2O,稀硝酸与铜反应生成NO,浓硝酸与铜反应生成NO2,B正确;
C.若D为NaCl,A为NaOH、E为CO2、B为Na2CO3、C为NaHCO3、X为盐酸,符合转化关系,C正确;
D.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2,X为NaOH,C为Fe2+,B为Fe3+,A为Cl2,E为Fe,才能实现转化关系,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后生成的气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为( )
A.5.4 gB.3.6 gC.2.7 gD.1.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组对某无色水样进行检验,已知水样中只可能含有K+、Mg2+、Cu2+、Al3+、CO32-、SO42-、C1-中的若干种离子。该小组取100mL水样进行实验,先滴加硝酸钡溶液,再滴加1mol·L-1的硝酸,实验过程中沉淀质量变化情况如图所示,下列分析错误的是

A. 一定含有的离子是:K+、SO42-、CO32-
B. BC段反应的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O
C. K+物质的量浓度的范围是: c(K+)≥0.6mol/L
D. 取少量水样置于试管中,滴加硝酸银溶液,可检验水样中是否含有C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )
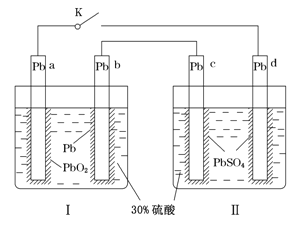
A. 闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42—
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. 闭合K时,Ⅱ中SO42—向c电极迁移
D. 闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.56 g Fe在足量Cl2中充分燃烧,转移电子数为2×6.02×1023
B.合成氨反应放热,采用低温可以提高氨的生成速率
C.常温下Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值减小
的值减小
D.若电工操作中将铝线与铜线直接相连会导致铜线更快被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应物和生成物均为气态的平衡体系,平衡常数表达式为K=![]() ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A. 升高温度,该反应平衡常数K的变化无法判断
B. 增大压强,W的质量分数增大
C. 该反应的化学方程式为3Z(g)+2W(g)![]() X(g)+2Y(g)
X(g)+2Y(g)
D. 增大X气体的浓度平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
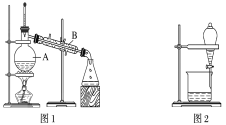
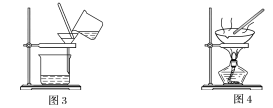
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ||||||
第三周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
第四周期 | ⑧ | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_________(填元素符号)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子式是:_________,碱性最强的化合物的电子式是:_________。
(3)元素⑤的单质与元素③的最高价氧化物对应的水化物反应的离子方程式为_________。
(4)元素②的简单氢化物是由_________ (填“极性”或“非极性”)键形成的,在常温下该化合物与元素⑥的单质反应的离方程式为__________________。
(5)元素②、③、⑥、⑧四种元素形成的离子,离子半径由大到小的顺序是_________ (用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com