
| ||
| ||
| ||
| ||
| ||
| ||
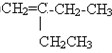 ,其名称为2-乙基-1-丁烯;
,其名称为2-乙基-1-丁烯;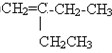 与氢气加成生成烷烃为,生成CH3CH2CH(CH2)CH2CH3,其名称为3-甲基戊烷;
与氢气加成生成烷烃为,生成CH3CH2CH(CH2)CH2CH3,其名称为3-甲基戊烷;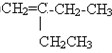 ;2-乙基-1-丁烯;3-甲基戊烷;
;2-乙基-1-丁烯;3-甲基戊烷;

科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| ||
| ||
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)写出实现下列变化的化学方程式,注明①②反应的类型.
(1)写出实现下列变化的化学方程式,注明①②反应的类型.

| 一定条件 |
| 一定条件 |
| ||
| ||
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高三上学期期中考试理综化学试(解析版) 题型:填空题
(14分)2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)  2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应的平衡常数表达式 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g)
△H=-56.9 kJ/mol
N2O4(g)
△H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)在一定条件下,也可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。则2 molCH4与足量H2O(g)反应最多可生成_______mol H2,写出该反应的化学方程式_________________________________________________。
(5)上述方法制得的H2可以和CO在一定条件下合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com