
【题目】某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。回收废旧锂电池中钴的工艺流程如下:

已知:Ksp(CoC2O4)=6.0×10-8,Ksp(CoCO3)=1.5×10-13。
回答下列问题:
(1) LiCoO2中,Co元素的化合价为______________。
(2)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。“浸出”中生成CoC2O4的化学方程式为__________,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(3)“转化”中加入Na2CO3溶液发生反应的离子方程式为______________,该反应进行的程度较大,试通过计算其平衡常数K并解释原因______________。
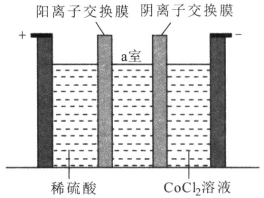
(4)“电解”时装置如图所示。阳极的电极反应式为_______,电解后a室中的电解液可返回工序继续使用。
(5)某废旧锂电池粉末中LiCoO2的质量分数为49%,将50吨该废料进行回收利用,电解得到钴5.9吨,则钴的回收率为_____________。
【答案】+3 2LiCoO2+5H2C2O4=2LiHC2O4+2CoC2O4+4H2O+2CO2↑ CoC2O4与过量的H2C2O4反应转化成Co(HC2O4)2而溶解 CoC2O4(s)+ CO32-(aq)![]() CoCO3(s) + C2O42-(aq) 该反应的平衡常数K=
CoCO3(s) + C2O42-(aq) 该反应的平衡常数K= =
= ![]() =
= ![]() = 4×105,反应正向进行的趋势很大 2H2O-4e-=O2↑+4H+ 40%
= 4×105,反应正向进行的趋势很大 2H2O-4e-=O2↑+4H+ 40%
【解析】
废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等,加草酸溶解,浸出液”的主要成分是LiHC2O4、Al(HC2O4),“浸出渣”的主要成分是CoC2O4,则生成CoC2O4的化学方程式为2LiCoO2+5H2C2O4=2LiHC2O4+2CoC2O4+4H2O+2CO2↑,H2C2O4用量过大时生成Co(HC2O4)2,然后加入碳酸钠发生CoC2O4+CO32-=CoCO3+C2O42-,分离出滤渣1为CoCO3,滤液1含草酸钠,滤渣1加盐酸溶解生成CoCl2,电解可得到Co,以此解答该题。
(1)LiCoO2中Li为+1价、O为-2价,则Co元素的化合价为+3价;
(2)“浸出”中生成CoC2O4的化学方程式为2LiCoO2+5H2C2O4=2LiHC2O4+2CoC2O4+4H2O+2CO2↑,若H2C2O4用量过大,CoC2O4与过量的H2C2O4反应转化成Co(HC2O4)2而溶解,导致CoC2O4的产率反而会降低;
(3)“转化”中加入Na2CO3溶液发生反应的离子方程式为CoC2O4(s)+CO32-(aq)CoCO3(s)+C2O42-(aq),该反应进行的程度较大,用平衡常数K解释原因为K= =
= ![]() =
= ![]() = 4×105,反应正向进行的趋势很大;
= 4×105,反应正向进行的趋势很大;
(4)由“电解”装置图可知,阳极的电极反应式为2H2O-4e-=O2↑+4H+,氢离子移向a,阴极区氯离子移向a,电解后a室中的电解液可返回酸溶工序继续使用;
(5)某废旧锂电池粉末中LiCoO2的质量分数为49%,将50吨该废料进行回收利用,电解得到钴5.9吨,则钴的回收率为 =40%。
=40%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温时,向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液pH变化如图所示。下列叙述错误的是
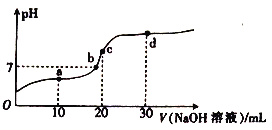
A. a点:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B. b点:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. C点:c(OH-)=c(CH3COOH)+c(H+)
D. d点:2c(Na+)=3[c(CH3COOH)+c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )

①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A. ③⑤ B. ②③ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中M、W、T、L为同一短周期元素,L核外最外层电子数是W核外电子数的一半。下列叙述正确的是

A.化合物ML属于离子化合物,也属于弱电解质
B.该新化合物中T满足8电子稳定结构
C.W的最高价氧化物可以与水反应生成弱酸
D.元素非金属性的顺序为W>T>L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用稀硫酸与锌粒制取氢气的实验探究影响化学反应速率的因素,反应速率与反应时间的关系如图,请回答下列问题:
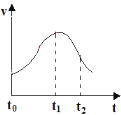
(1)t0~t1间反应速率增大的原因是___。
(2)若在t2时刻向溶液中加入少量CuSO4固体,反应速率明显加快,对此大家展开研究:
①有人认为是加入的SO42-催化了反应。他的观点___(填“正确”或“不正确”)。如何设计实验加以证明?___。
②有同学发现当加入较多CuSO4固体时,反应速率反而下降,可能的原因是___。
(3)如要加快t0时刻气体产生的速率,从反应物角度看,可采取的措施有___(至少答两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是( )

A. 1mol该物质最多可与2molNaOH反应
B. 能发生加成、取代、不能发生消去反应
C. 不能使溴水褪色
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去)。已知下列数据:

乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
请回答下列问题:
(1)仪器C的名称为______,球形冷凝管的作用是_____。
(2)向C中加入反应物,待充分反应后,将C中的混合物倒入装有饱和碳酸钠溶液的烧杯中充分振荡洗涤。饱和碳酸钠溶液作用是(填字母):_____
A.中和乙酸并溶解乙醇
B.碳酸钠溶液呈碱性,有利于乙酸乙酯的水解
C.加速乙酸乙酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(3)经多次振荡洗涤、静置分液后,为了进一步提纯乙酸乙酯,可采用蒸馏的方法,蒸馏时控制温度在__左右,温度计的水银球应位于____。
(4)若实验所用乙酸质量为2.4g,乙醇质量为2.1g,得到纯净的产品质量为2.64g,则乙酸乙酯的产率是______。
(5)乙酸乙酯与氢氧化钠溶液发生反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学家运用穿山甲的鳞片特征,制作出中弹后可自我恢复的防弹衣!这神奇的秘密就在于它的分子结构,它以一种独特方式连接在一起(图示如下),所以分子能保留对最初形状的记忆。这种记忆结构使得鳞片能够经受住外部的强力物理冲击,而且用水就能唤起这种记忆,同时在可变形的参与下进行自我修复,只要这种鳞片保持完整,无论变形有多严重,都可以完全恢复到初始状态。

试分析并回答:
(1)该耐高温的高分子液晶树脂的单体是A(呈碱性)和_______(B),链内官能团主要是_________(均写名称)。
(2)C=OH-N中,除共价键外,还有______(写作用力名称)。
(3)苯与足量硝酸(混酸)作用往往得到间二硝基苯,混酸又要氧化-NH2,所以制取上述单体A有难度。据查其中的两种方法如下:

I.b的化学方程式是_________;
II.完成对硝基苯胺制取的路线:_________
![]() 。
。
(4)B的符合下列条件的同分异构体是________(写结构简式)。
①能发生银镜反应;②仍是苯环上的对位二取代物或仅一取代物;③分子中不含酚羟基、O-O键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com