
| A. | 反应①使用催化剂,能降低该反应的活化能 | |
| B. | 反应②为吸热反应 | |
| C. | 反应③将化学能转化为光能 | |
| D. | 反应CO(g)+H2O(g)═CO2(g)+H2(g);△H=-82.4 kJ•mol-1 |
分析 A.催化剂能降低该反应的活化能加快反应速率;
B.△H2<0,为放热反应;
C.光照条件下,催化分解水蒸气生成氧气,为光能转化为化学能;
D.根据①③构建目标方程式结合盖斯定律计算分析.
解答 解:A.催化剂能改变化学反应速率是因为催化剂参与了化学反应,改变了反应路径,降低了反应的活化能,从而使活化分子数和活化分子百分数增多,反应速率加快,故A正确;
B.反应②过氧化氢分解生成氧气:2H2O2(l)═2H2O(l)+O2(g);△H2=-196.4kJ•mol-1,表示每分解2mol过氧化氢,放出196.4KJ的热量,故B错误;
C.光照条件下,催化分解水蒸气生成氧气:2H2O(g)═2H2(g)+O2(g);△H3=483.6kJ•mol-1,该反应为吸热反应,为光能转化为化学能,故C错误;
D.①2CO2(g)═2CO(g)+O2(g);△H1=566kJ•mol-1,③2H2O(g)═2H2(g)+O2(g);△H3=483.6kJ•mol-1,由(③-①)÷2,得反应CO(g)+H2O(g)═CO2(g)+H2(g),根据盖斯定律△H=[(483.6kJ•mol-1)-(566kJ•mol-1)]÷2=-41.2kJ•mol-1,故D错误;
故选A.
点评 本题考查反应热与焓变、能量的转化等知识,为高频考点,把握反应中能量变化、盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 甲为铁锈 | B. | 乙为FeO | C. | 丙为NO2 | D. | 丁为CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z既能形成离子化合物.又能形成共价化合物 | |
| B. | Y和Z元素的原子半径大小顺序为Y>Z | |
| C. | X与Y、Z之问形成的核外电子总数为10的微粒只有YX3和X2Z | |
| D. | Z、W元索的最简单氢化物的沸点和稳定性均为H2Z>H2W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | 铁粉具有还原性 | 袋装食品的抗氧剂 |
| B | 铁离子的氧化性比铜离子强 | FeCl3溶液腐蚀Cu刻制印刷电路板 |
| C | Na2O2能与CO2反应生成氧气 | 呼吸面具中的氧气来源 |
| D | SO2具有漂白性 | 豆芽菜、银耳等食品的漂白 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量Cl2充分反应,转移电子数为0.2×6.02×1023 | |
| B. | 由PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O可确定氧化性:PbO2>Cl2 | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 常温下,用蒸馏水不断稀释0.1 mol•L-1醋酸,溶液中c(H+)/c(CH3COOH)的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
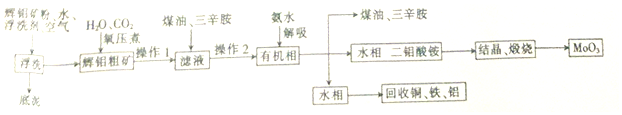
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 保护钢铁水闸门可用外接电源阳极保护法 | |
| B. | 反应NH3(g)+HI(g)═NH4I(s)在低温下可自发进行,则△H>0,△S>0 | |
| C. | 常温下,向0.lmol•L-1CH3COONa溶液中滴加盐酸,溶液中水的电离程度增大 | |
| D. | 恒温下进行的反应2NO2(g)?N2O4(g)达平衡时,缩小容器体积再达平衡时,气体 的颜色比第一次平衡时的深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
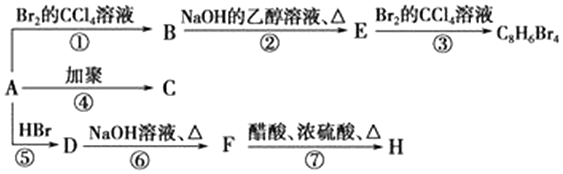
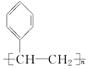
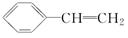 .
. ,D
,D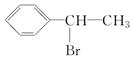 ,E
,E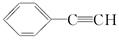 ,H
,H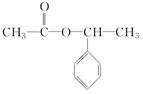 .
. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr.写出⑦反应的化学方程式
+NaBr.写出⑦反应的化学方程式 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$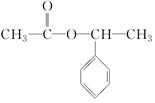 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,1molCH4和2molCH4的燃烧热不同,后者是前者的2倍 | |
| B. | 对于一个确定的反应,反应热的大小与反应路径有关 | |
| C. | 对于反应CaCO3(s)═CaO(s)+CO2(g)△H=+178.2kJ/mol,在高温下才能发生分解,说明能量变化是物质变化的基础 | |
| D. | 化学平衡常数(K)的大小反映了化学反应进行的程度,K值越大,反应物的转化率越高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com