
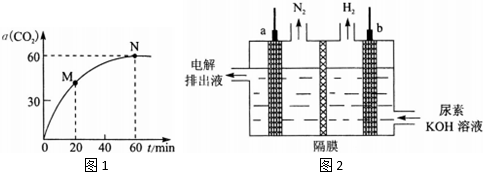
分析 (1)该过程实际上分两步进行,第一步产生氨基甲酸铵,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4;
(2)A.图象纵坐标表示二氧化碳的转化率,横坐标表示时间变化,图象表示的二氧化碳的转化率随着时间的变化关系,转化率=$\frac{转化量}{初始量}$,反应未达到平衡前二氧化碳的转化率始终变化,只有达到平衡才能保持不变,所以可以作为判断平衡的标志;
B.三段式表示各物质的物质的量的关系,套用公式求解;
C.反应达到平衡后再增加氨气的用量可以是平衡进一步向正反向移动,消耗的二氧化碳增多,故转化率提高.
D.M点达到平衡时V(正)=V(逆),所以比较M点的逆反应速率与N点的正反应速率可以转化为比较M点的逆反应速率和N点的逆反应速率;
(3)依据反应自发进行的判断依据是△H-T△S<0,结合反应特征分析,低温下自发进行,说明正反应是放热反应,所以升高温度,平衡常数K减小;
(4)尿素为固体,开始在一密闭容器中充入0.1molNH3、0.65mol CO2、0.65molH2O(g),相当于增大压强,平衡正向移动,混合气体的平均相对分子量变小;(5)25℃氨水的电离常数为1.7×10-5,氰酸HCNO的电离常数为3.3×10-4,所以氰酸铵水溶液中铵离子的水解程度大于氰酸根离子的水解程度,溶液呈酸性;
(6)尿素[CO(NH2)2]中的氮由-3价到0价,发生氧化反应,所以a为阳极,电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O;根据关系式:CO(NH2)2~6e-~3H2,来求解.
解答 解:(1)该过程实际上分两步进行,第一步产生氨基甲酸铵,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4,故答案为:2NH3(g)+CO2(g)?NH2COONH4;
(2)A.从图象中可知0-60min二氧化碳的转化率始终增大,到60min后保持不变,说明该反应达到平衡,故A正确;
B.设氨气的物质的量为4mol,则二氧化碳的物质的量为1mol,平衡时消耗的二氧化碳为1×60%=0.6
2NH3+CO2 $\stackrel{一定条件}{?}$ CO(NH2)2+H2O
初始量(mol) 4 1 0 0
转化量(mol) 1.2 0.6
则氨气的转化率=$\frac{1.2}{4}$×100%=30% 故B错误;
C.反应达到平衡后再增加氨气的用量可以使平衡进一步向正反向移动,二氧化碳转化率提高,故C正确;
D.N点反应达到平衡,N点的正反应速率υ正(CO2)等于N点的逆反应速率υ逆(CO2),M点时生成物的浓度低于N点的浓度所以M点的逆反应速率υ逆(CO2)小于N点的逆反应速率υ逆(CO2),也就是小于N点的正反应速率υ逆(CO2),故D错误;
故选BD;
(3)依据反应自发进行的判断依据是△H-T△S<0,结合反应特征分析,低温下自发进行,说明正反应是放热反应,所以升高温度,平衡常数K减小,故答案为:减小;
(4)尿素为固体,开始在一密闭容器中充入0.1molNH3、0.65mol CO2、0.65molH2O(g),相当于增大压强,平衡正向移动,混合气体的平均相对分子量变小,故答案为:变小;
(5)25℃氨水的电离常数为1.7×10-5,氰酸HCNO的电离常数为3.3×10-4,所以氰酸铵水溶液中铵离子的水解程度大于氰酸根离子的水解程度,溶液呈酸性,所以离子浓度大小顺序为:c(CNO-)>c(NH4+)>c(H+)>c(OH-),故答案为:c(CNO-)>c(NH4+)>c(H+)>c(OH-);
(6)尿素[CO(NH2)2]中的氮由-3价到0价,发生氧化反应,所以a为阳极,电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O;根据关系式:CO(NH2)2~6e-~3H2,所以尿素的质量为:$\frac{60×224×1{0}^{-3}}{3×22.4}$=0.2g,故答案为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O;0.2.
点评 本题考查了化学平衡状态概念、特征、平衡转化率的求算、方程式的书写和电极反应式的书写,题目难度中等,解此类题关键要看清图象表达的含义,运用平衡理论求解.


科目:高中化学 来源: 题型:选择题
| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I-、SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验:| A. | 由实验①只能确定原溶液中一定有NH4+,没有Fe2+. | |
| B. | 取实验②后的溶液滴加淀粉溶液,可能变蓝色. | |
| C. | 原溶液中可能含有NH4+、Na+、SO32-、I-四种离子 | |
| D. | 取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中加少量的CH3COONa固体,平衡正向移动 | |
| B. | 0.10 mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向沸水中滴加饱和氯化铁溶液,可以制备氢氧化铁胶体,有净水的功能 | |
| B. | 容量瓶、滴定管使用前均需要检漏,并需要润洗以减小实验误差 | |
| C. | 甲烷中混有的少量乙烯可以通过溴水洗涤净化 | |
| D. | 分离乙酸乙酯和乙酸混合液时,先加入一定量的氢氧化钠溶液,生成乙酸钠后进行蒸馏,然后在乙酸钠溶液中加入足量的硫酸再蒸馏可得乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 用图丙所示仪器配制0.150mol/LNaOH溶液 | |
| D. | 如图丁所示可用于实验室制氨气并收集干燥的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com