
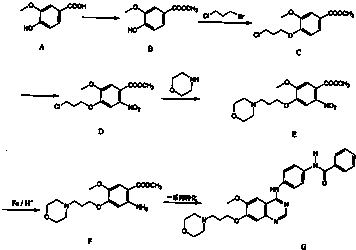
1 |
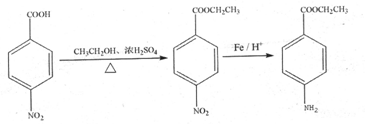
 )为原料合成对氨基苯甲酸乙酯(
)为原料合成对氨基苯甲酸乙酯(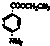 )的合成路线(试剂任选,用合成路线流程图表示)
)的合成路线(试剂任选,用合成路线流程图表示)| HBr |
| NaOH |
| 水/△ |
1 |
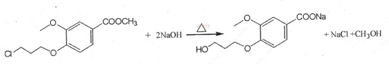 ,
, ;
;1 |
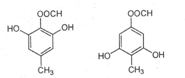 ,故答案为:
,故答案为: ;
; ,
, .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
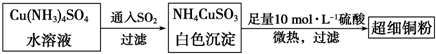
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.
常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料.某探究小组利用下列反应和装置制备一硝基甲苯.| 密度/g?cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.05×10-4mol?L-1 |
| B、5.56×10-3mol?L-1 |
| C、1.01×10-4mol?L-1 |
| D、1.01×10-3mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
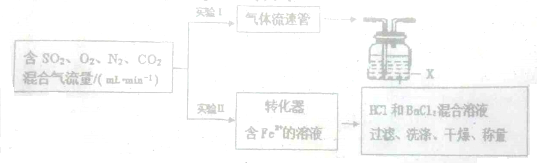
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
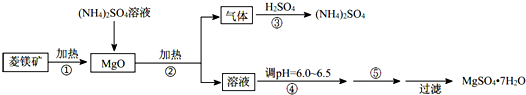
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com