
【题目】有失去标签的NaCl、FeCl2、FeCl3、MgCl2四种溶液,只需要一种试剂就可以把它们鉴别开来,这种试剂是( )
A.氨水B.硝酸银溶液C.Na2SO4溶液D.KSCN溶液
科目:高中化学 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
A. H3 PO2属于三元酸 B. H3 PO2的结构式为
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到。下列有关甲、乙的说法不正确的是
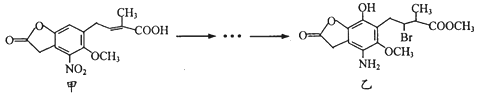
A. 甲的分子式为C14H11NO7
B. 甲和乙所含官能团均为5种
C. 可用NaHCO3溶液鉴别化合物甲和乙
D. 甲能与酸性高锰酸钾溶液反应,乙能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物V: 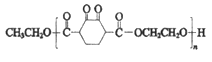 是人造棉的主要成分之一,合成路线如下:
是人造棉的主要成分之一,合成路线如下:
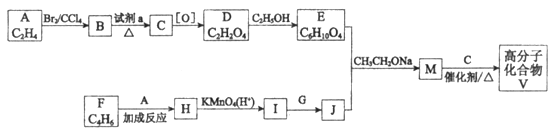
已知:
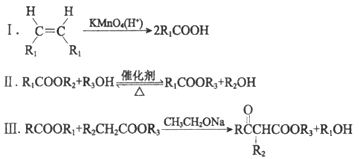
(R、R1、R2、R3表示烃基)
(1)试剂a是____________________________。
(2)F与A以物质的量之比1:1发生反应生成六元环状化合物H,H的结构简式是________________。
(3)I的结构简式是____________。
(4)G中所含官能团是________________;M的结构简式是____________。
(5)M与C反应生成V的化学方程式为____________。
(6)E的同分异构体N也可以和J反应生成M,N可能的结构简式为____________(写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )

A. 2molH2(g)跟1molO2(g)反应生成2molH2O(g)吸收能量为490kJ
B. 1molH2(g)跟0.5molO2(g)反应生成1molH2O(l)吸收能量为245kJ
C. 2molH2O(g)的能量比2molH2(g)与1molO2(g)的能量之和低
D. 化学反应中能量变化的大小与反应物的质量多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组收集“铜与浓硝酸反应”生成的气体进行探究。试回答下列问题
(1)下图是“铜与浓硝酸反应”的实验装置
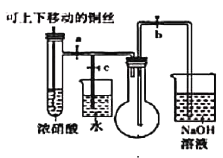
①指出装置中的错误_________________________。
②装置改进后,为了使生成的气体充满烧瓶,实验时先关闭弹簧夹_______,再打开弹簧夹________。
③当气体充满烧瓶后,___________________________,即可使反应停止。
(2)当烧瓶中充满红棕色的气体时停止实验,取下烧瓶,塞好橡皮塞。
①把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,烧瓶中水面上升,根据化学方程式3NO2+H2O=2HNO3+NO计算烧瓶中溶液的浓度是______mol/L(假设溶质未扩散到水槽,且当时条件下气体的摩尔体积为25L/mol)
②把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,实验时发现烧瓶中液面上升几乎充满了整个烧瓶,产生这种现象的原因可能是收集的NO2中含有__________。
A.NO B.N2O4 C.O2 D.空气
③小组同学查阅资料发现,NO2溶于水时能生成硝酸和亚硝酸:2NO2+H2O=HNO3+HNO2,为了证明这是造成剩余气体少的主要原因,小组同学把烧瓶中的溶液滴加高锰酸钾溶液,发现高锰酸钾溶液褪色,写出高锰酸钾溶液褪色的离子方程式____________________________。
(3)HNO2是一种不稳定易分解的弱酸:Ⅰ.2HNO2=NO↑+NO2↑+H2O,Ⅱ.3HNO2=HNO3+2NO↑+H2O。为了探究不同温度、浓度下亚硝酸的分解产物,小组同学进行如下实验:
第一步:配制1mol/LNaNO2溶液100mL(标为溶液A)。
第二步:取溶液A分别加水稀释为0.5mol/L、0.2mol/L、0.1mol/L的溶液,依次标为溶液B、C、D。
第三步:分别取两滴管溶液A~D溶液于试管中,塞上橡皮塞后置于不同温度的水中加热5min,再加入一滴管10mol/LH2SO4溶液并立即塞紧橡皮塞,观察生成气体的颜色
水浴温度/℃ | A | B | C | D |
沸水浴 | 红棕色 | 红棕色 | 红棕色 | 红棕色 |
80-70 | 红棕色 | 红棕色 | 红棕色 | 无色 |
50-40 | 红棕色 | 仅液面上红棕色 | 无色 | 无色 |
20-10 | 仅液面上红棕色 | 无色 | 无色 | td style="width:88.95pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">
①第一步实验要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和___________。
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是______________。
③通过实验现象得出结论:____________条件下,亚硝酸按反应Ⅰ发生分解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电极反应的说法正确的是
A.原电池正极和电解池阳极发生还原反应B.原电池正极和电解池阴极发生氧化反应
C.原电池负极和电解池阳极发生氧化反应D.原电池负极和电解池阴极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆,抗腐蚀性强的金属,常用于电镀和制造特种钢,基态Cr原子中,电子占据最高能层的符号为___,该能层上具有的原子轨道数为___。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?___(填“是”或“否”),原因是______________(如果前一问填“是”,此问可以不答)。
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与____个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为_____;
(4)与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型为____;一定压强下将AsH3、NH3和PH3的混合气体降温时首先液化的是_______,理由是__________;
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为__g.cm﹣3(用含a和NA的式子表示)
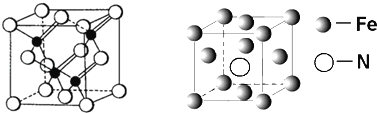
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com