
| A. | ①②③④ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③ |
分析 N、O、F元素的电负性较强,对应的氢化物可形成氢键,氢键是一种较强的分子间作用力,是由电负性强的原子(如F,O,N)对氢原子的吸引力产生的,能够影响物质的熔点、沸点、密度等,以此解答该题.
解答 解:①氨气分子之间能形成氢键,熔、沸点高,所以NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高,故正确;
②小分子的醇、羧酸含有-OH,与水分子之间形成氢键,可以和水以任意比互溶,故正确;
③邻羟基苯甲酸主要存在分子内氢键,对羟基苯甲酸主要存在分子间氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低,故正确;
④水分子中O-H的键能很大,所以水分子在高温下也很稳定,与氢键无关,故错误;
⑤非金属性越强,其氢化物越稳定,所以水分子较硫化氢分子稳定,与氢键无关,故错误;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 春节燃放爆竹对环境无污染 | |
| B. | “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 家庭用的“84”消毒液与洁厕灵可同时混合使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)、c(SO42-)均增大 | |
| B. | c(Ba2+)=c(SO42-)=[Ksp(BaSO4)]1/2 | |
| C. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)=Ksp(BaSO4) | |
| D. | c(Ba2+)≠c(SO42-),c(Ba2+)•c(SO42-)≠Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Zn2+的浓度不变 | |
| B. | 沉淀溶解后,将生成配合离子[Zn(NH3)4]2+ | |
| C. | 用硝酸锌溶液代替硫酸锌溶液进行实验,能观察到同样的现象 | |
| D. | 在[Zn(NH3)4]2+离子中,NH3给出孤对电子,Zn2+提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
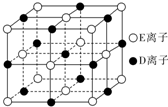 A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物对应的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子.G元素与D元素同主族,且相差3个周期.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | Fe3O4俗称铁红,可用作红色涂料 | |
| C. | Na2CO3俗称纯碱,可作为制造玻璃的原料 | |
| D. | KAl(SO4)2•12H2O俗称明矾,可作为净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
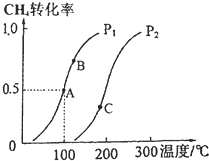 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com