
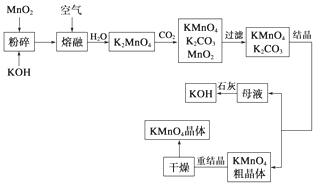
分析 (1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,再由元素化合价的结合质量守恒定律配平可得;
(3)向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,所含元素化合价升高的反应物是还原剂;
(4)根据原子守恒知,1molMnO2可制得1molK2MnO4,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3.
解答 解:(1)高锰酸钾具有强氧化性,常常利用高锰酸钾的强氧化性进行消毒,
A、酒精是通过渗透到细菌体内,使细菌蛋白质凝固(变性),从而杀死细菌,故错误;B、双氧水具有强氧化性,常常利用双氧水的强氧化性进行杀菌消毒,故正确;C、次氯酸钠具有强氧化性,常常利用次氯酸钠的强氧化性进行杀菌消毒,故正确;
故答案为:BC;
(2)MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
故答案为:2MnO2+4KOH+O2 $\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(3)由工艺流程转化关系可知,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,反应只有Mn元素的化合价发生变化,由+6价降低为+4价,由+6价升高为+7价,所以K2MnO4既是氧化剂又是还原剂;
故答案为;K2MnO4;
(4)根据原子守恒知,1molMnO2可制得1molK2MnO4,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,反应方程式为3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,3mol锰酸钾生成2mol高锰酸钾,所以1mol二氧化锰生成$\frac{2}{3}$mol高锰酸钾;
故答案为:$\frac{2}{3}$.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 某单质固体能导电,该单质一定是金属 | |
| B. | 某元素原子最外层只有一个电子,该元素一定属于金属元素 | |
| C. | 某纯净物在常温常压下为气体,则组成该物质的微粒一定含共价键 | |
| D. | 某化合物熔融态能导电,该化合物中一定有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和H2O+互为同分异构体 | |
| B. | H2O+有较强的氧化性 | |
| C. | 水分子形成的“网”是一种新化合物 | |
| D. | H2O(s)→H2O(l)→H2O(g)的变化过程中会破坏H-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 氧化物 | 含氧酸 | 碱 | 盐 | |
| A | 空气 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
| B | 冰水混合物 | Na2O | NaHSO4 | NaOH | NaCl |
| C | 水煤气 | CuO | HCl | NH3.H2O | CaF2 |
| D | 盐酸 | Na2O2 | HNO3 | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、HCO3-、NO3- | B. | Fe3+、SCN-、Cl-、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
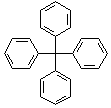 甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有碳原子可能在同一平面上 | |
| C. | 该化合物分子一定处于同一平面的原子至少有12个 | |
| D. | 分子中可能处于同一平面的原子最多有23个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的气态氢化物的水溶液具有强酸性 | |
| B. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| C. | R是金属元素 | |
| D. | R的气态氢化物不能在氧气中燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com