
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)C单质分子的结构式 ______________________;
(3)元素D与元素A相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是 ______(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _______________,试写出Y与H2O2溶液反应的化学方程式: __________________________________________;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为_________。
【答案】 第三周期第ⅥA族 ![]() Cl bde
Cl bde ![]()
![]() 1:2
1:2
【解析】由表中信息可知,A为S元素,B为Na元素,C为N元素,D为Cl元素。 通常根据非金属元素形成的气态氢化物的稳定性、最高价氧化物对应的水化物的酸性和非金属间的置换来判断非金属元素的非金属性强弱。H2O2溶液有强氧化性,可以把二氧化硫氧化为硫酸。
由表中信息可知,A为S元素,B为Na元素,C为N元素,D为Cl元素。
(1)A元素在周期表中的位置是第三周期第ⅥA族;
(2)C单质为氮气,其结构式为![]() ;
;
(3)元素D与元素A相比,非金属性较强的是Cl。
a.常温下D的单质和A的单质状态不同 ,单质的状态与非金属性强弱没有必然关系;
b.D的氢化物比A的氢化物稳定,可以证明氯元素的非金属性强于硫元素;
c.一定条件下D和A的单质都能与钠反应 ,只能证明两者均有一定的非金属性,但不能证明两者的非金属性的强弱关系;
d.A最高价含氧酸的酸性弱于D最高价含氧酸 ,可以证明氯元素的非金属性强于硫元素;
e.D单质能与A的氢化物反应生成A单质 ,可以证明氯元素的非金属性强于硫元素;
综上所述,能证明氯元素的非金属性强于硫元素这一事实的是bde。
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,则Y为二氧化硫,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,H2O2溶液有强氧化性,可以把二氧化硫氧化为硫酸,故溶液中有白色沉淀生成,则该白色沉淀为![]() ,Y与H2O2溶液反应的化学方程式为
,Y与H2O2溶液反应的化学方程式为![]() ;
;
②若Z是红棕色气体,则Z为二氧化氮,Z→W的反应生成硝酸和一氧化氮,二氧化氮既是氧化剂又是还原剂,根据元素的化合价升降数值,可以判断其中氧化剂与还原剂物质的量之比为1:2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯和苯都可以使溴水褪色
B.甲烷和乙烯都可以与氯气反应
C.乙烯可以与氢气发生加成反应,苯不能与氢气加成
D.液化石油气和天然气的主要成分都是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(气)+N(气)R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
A.正反应吸热,S是气体
B.正反应吸热,S是固体
C.正反应放热,S是气体
D.正反应放热,S是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有 K+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验:(所加试剂均过量,气体全部逸出)下列说法不正确的是

A. 原溶液中一定存在SO42–、CO32–和NH4+
B. 原溶液中一定不存在Ca2+,无法判断Cl–是否存在
C. 要确定Cl–是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D. 原溶液中 c(K+ )≥0.1 mol· Lˉ 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答: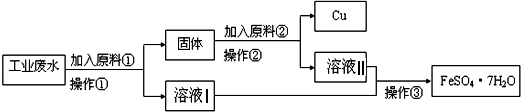
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔和乙烯都是基本的重要有机化工原料。由它们和常见的有机物可合成一种醚类香料和制备聚乙烯醇缩丁醛。具体合成路线如图所示(部分反应条件和产物略去):

已知以下信息:
![]() 。
。
回答下列问题:
(1)A的名称是_________________,D中含有的官能团名称是________________________。
(2)B的结构简式为__________________。聚乙烯醇缩丁醛的分子式为_________________________。
(3)⑦的反应类型是__________________________。
(4)写出反应③的化学方程式:_____________________________________。
(5)M 与碳酸二甲酯(![]() )互为同系物,满足下列条件的M 的同分异构体共有______种。其中核磁共振氢谱有3组峰,峰面积之比为3 :2 :3,该同分异构体的结构简式为________________。
)互为同系物,满足下列条件的M 的同分异构体共有______种。其中核磁共振氢谱有3组峰,峰面积之比为3 :2 :3,该同分异构体的结构简式为________________。
①相对分子质量比碳酸二甲酯多14;
②酸性条件下能发生水解,且水解后的产物不含 结构;
结构;
③分子中不含醚键结构(![]() )。
)。
(6)参照上述合成路线,设计一条由2-氯丁烷和必要的无机试剂制备 的合成路线(注明必要的反应条件)。___________________
的合成路线(注明必要的反应条件)。___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com