
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
描述一个原子轨道要用________个量子数,其符号分别是________,表征电子自旋
方向的量子数有________个,可用符号________表示。3d能级中原子轨道的主量子数为___,该能级的原子轨道最多可以有________个空间取向,最多可容纳__________个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是
A.锌为正极,空气进入负极反应 B.负极反应为:Zn-2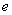 -=Zn2+
-=Zn2+
C.正极发生氧化反应 D.正极反应为: Zn-2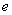 -=Zn2+
-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.醋酸钠的水解反应CH3COO-+H3O+===CH3COOH+H2O
B.碳酸氢钙与少量的NaOH溶液反应Ca2++2HCO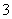 +2OH-===CaCO3↓+2H2O+CO
+2OH-===CaCO3↓+2H2O+CO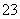
C.向AgCl悬浊液中滴加NaI溶液AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)
D.稀硝酸与过量的铁屑反应Fe+4H++NO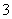 ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
A.Th元素的质量数是232
B.230Th和232Th的化学性质相同
C.232Th转化成233U是化学变化
D.Th元素的相对原子质量是231
查看答案和解析>>
科目:高中化学 来源: 题型:
一个原电池的总反应方程式为Zn+Cu2+===Zn2++Cu,该原电池可能为( )
| A | B | C | D | |
| 正极 | Cu | Al | Zn | Fe |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列事实,判断离子的氧化性顺序为①A+B2+===A2++B②D+2H2O===D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+ ( )
A.D2+>A2+>B2+>E2+ B.D2+> E2+ >B2+> A2+
C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)===Si(s)+4HCl(g)
ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器中进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液中恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A.28g N2含有的氮原子数目为NA
B.常温常压下,22.4L Cl2含有的分子数目为NA
C.1molNa变为Na+时失去的电子数目为NA
D.1L 1mol·L—1K2CO3溶液中含有的钾离子数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com