
 如图所示是高炉炼铁时高炉内的化学变化过程:认真阅读有关信息,回答下列问题:
如图所示是高炉炼铁时高炉内的化学变化过程:认真阅读有关信息,回答下列问题:
| ||
| ||
| ||
| ||


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:

| A、在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B、溶液酸性越强,R的降解速率越小 |
| C、R的起始浓度越小,降解速率越大 |
| D、在20~25 min之间,pH=10时R的平均降解速率为0.04 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠可保存在煤油中 |
| B、金属钠可将铁从其溶液中转换出来 |
| C、钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为放热反应 |
| D、钠在空气中能发生缓慢氧化而发生自燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图5,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图5,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | c(CrO42-) | c(HCrO4-) | c( Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 |
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 |
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
| A、铬酸的第一步电离是完全电离 |
| B、铬酸的第二步电离是部分电离,且存在两种电离方式 |
| C、pH越大,电离出的CrO42-浓度越大 |
| D、溶液中存在2HCrO4-?Cr2O72-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量S2-的溶液:ClO-、Na+、Cl-、CO32- |
| B、无色澄清溶液:MnO4-、SO42-、K+、Fe3+ |
| C、能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+ |
| D、能使石蕊试液变蓝色的溶液:HCO3-、NH4+、Cl?、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
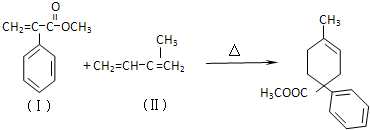
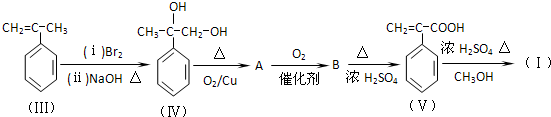
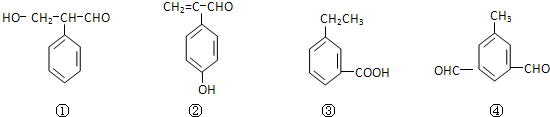
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com