
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 离子晶体中只含有离子键 | |
| D. | 分子晶体中只存在分子间作用力,不含化学键 |
分析 A.金属晶体含有阳离子,但不含阴离子;
B.原子晶体是原子间通过共价键形成的空间网状结构晶体;
C.离子晶体可含有离子键和共价键;
D.分子晶体中,构成分子的原子之间可形成化学键.
解答 解:A.金属晶体由金属离子和自由电子构成,含有阳离子,但不含阴离子,故A错误;
B.原子晶体是原子间通过共价键形成的空间网状结构晶体,由非金属元素组成,只含有共价键,故B正确;
C.离子晶体可含有离子键和共价键,如NaOH,故C错误;
D.分子晶体中,构成分子的原子之间可形成化学键,如H2O含有O-H键,故D错误.
故选B.
点评 本题考查晶体的构成和性质,注意把握组成微粒和粒子间的作用力,侧重于基础知识的考查,难度不大.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 10 mL | B. | 20 mL | C. | 30 mL | D. | 36.7 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正价:X>Y>Z | B. | 酸性:H3ZO4>H2YO4>HXO4 | ||
| C. | 稳定性:HX>H2Y>H3Z | D. | 非金属性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯 | B. | 二甲苯 | C. | 苯 | D. | 环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl3+2H2O
+3FeCl3+2H2O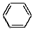 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
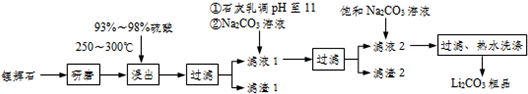
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com