
【题目】常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算(写出计算步骤):
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度(计算结果保留两位小数,下同)。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
【答案】
(1)20%;
(2)2.28mol·L-1
(3)2.48mol
【解析】(1)混合后溶液中的质量为:20.0g+30.0g=50.0g,溶质硝酸钾的质量为:20.0g×14%+30.0g×24% =10.0g,混合后溶液的质量分数: ![]() ×100%=20%,答:混合后溶液的质量分数为20%;
×100%=20%,答:混合后溶液的质量分数为20%;
(2)混合溶液的体积为: ![]() =43.48mL=0.04348L,溶液中溶质的物质的量为:
=43.48mL=0.04348L,溶液中溶质的物质的量为: ![]() =0.099mol,混合后溶液的物质的量浓度为:
=0.099mol,混合后溶液的物质的量浓度为: ![]() =2.28mol/L,答:混合后溶液的物质的量浓度为2.28mol/L;
=2.28mol/L,答:混合后溶液的物质的量浓度为2.28mol/L;
(3)设需要硝酸钾的物质的量为xmol,硝酸钾的质量为101x,根据(1)可知,硝酸钾的质量分数为20%,则ω=20%= ![]() =
= ![]() ×100%,解得:x≈2.48mol,答:在1 000g水中需溶解2.48molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
×100%,解得:x≈2.48mol,答:在1 000g水中需溶解2.48molKNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
【考点精析】根据题目的已知条件,利用溶解度、饱和溶液的概念的相关知识可以得到问题的答案,需要掌握在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫作这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,叫作不饱和溶液;在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫作这种物质在这种物质在这种溶剂里的溶解度.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量. 
(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的(填“正极”或“负极”),并写出B极发生反应的电极反应式 .
(2)电解开始一段时间后,在U形管中可观察到的现象 .
并写出该电解反应总的离子方程式 .
(3)实验中还需测定的数据是(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中只可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、CO ![]() 、SO
、SO ![]() 中的一种或几种,对其进行如下实验操作:( )
中的一种或几种,对其进行如下实验操作:( )
⑴取少量溶液,滴加无色酚酞试液,酚酞变红;
⑵另取少量溶液,加入足量BaCl2溶液,产生白色沉淀;
⑶向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
⑷将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成。
下列对该溶液的说法正确的是
A.一定含有OH-、CO ![]() 、SO
、SO ![]() 、Cl-
、Cl-
B.可能含有K+、Cl-
C.一定不含有Ag+、Ba2+、Cu2+
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.01mol氯化铬(CrCl36H2O)在水溶液中用过量AgNO3处理,产生0.02mol AgCl沉淀,此氯化铬最可能为( )
A.[Cr(H2O)6]Cl3
B.[Cr(H2O)5Cl]Cl2H2O
C.[Cr(H2O)4Cl2]Cl2H2O
D.[Cr(H2O)3Cl3]3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用单线桥标出电子转移的方向与数目;NaH能与水剧烈反应NaH +H2O=NaOH+H2↑,NaH与液氨也有类似反应,写出反应的化学方程式。
(2)配平反应方程式:。![]() Al+
Al+ ![]() NaNO3+
NaNO3+ ![]() H2O=
H2O= ![]() Al(OH)3+
Al(OH)3+ ![]() N2↑+
N2↑+ ![]() NaAlO2
NaAlO2
(3)实验室用MnO2和浓盐酸制氯气的反应为MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
MnCl2+2H2O+Cl2↑。反应中,如果有17.4 g纯MnO2被还原,那么:
①被氧化的氯化氢的质量为。
②转移电子的数目为。
③纺织工业中常用氯气作漂白剂,漂白布匹后,过量的氯需要除去,通常可用Na2SO3作“脱氯剂”,脱氯后的产物为Na2SO4 , 氯变为-1价。若把本题中产生的Cl2完全转化,需要Na2SO3的质量为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包铁粉和氧化铜混合均匀的粉末样品4.40g,加入50mL稀硫酸恰好充分反应后,得到只含一种金属阳离子的浅绿色溶液和1.28g固体铜.并放出H2 . 试计算:
(1)固体铜的物质的量为mol,该样品中铁粉和氧化铜的物质的量之比为 .
(2)硫酸的物质的量的浓度molL﹣1 , 产生H2在标准状况下的体积L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3是一种重要的化工原料.某课外探究小组尝试制取无水AlCl3 , 查阅资料获得下列信息:无水AlCl3在178℃升华,极易潮解,遇水蒸气产生白色烟雾.
探究一 无水AlCl3的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉(已除去氧化膜)反应制取无水AlCl3 . 供选择的药品:①铝粉 ②浓硫酸 ③稀盐酸 ④饱和食盐水 ⑤二氧化锰粉末 ⑥无水氯化钙 ⑦稀硫酸 ⑧浓盐酸 ⑨氢氧化钠溶液
(1)写出装置A烧瓶中发生的反应方程式 .
(2)实验开始前,先检查装置气密性,后装入药品,接下来的步骤依次是(填序号)
a.加热D中硬质玻璃管 b.往A烧瓶中加入液体 c.点燃A中的酒精灯
(3)写出无水AlCl3与水蒸气反应的化学方程式 .
探究二 无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如表:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 | 2.0g | 2.0g | 2.0g |
氢气的体积 | 334.5mL | 336.0mL | 337.5mL |
(4)根据表中数据,计算所得固体中无水AlCl3的质量分数 .
(5)有同学认为测得的无水AlCl3的质量分数偏低,你认为可能的原因有:(填序号)
①制备的氯气不足,②固体和气体无法充分接触,③无水AlCl3发生升华,造成损失.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是( )
A.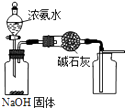
用图装置制取干燥纯净的NH3
B.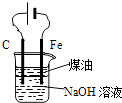
用图装置实验室制备Fe(OH)2
C.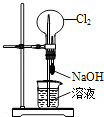
用图装置可以完成“喷泉”实验
D.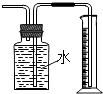
用图装置测量Cu与浓硝酸反应产生气体的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com