

| A. | 溶液与胶体属于包含关系 | |
| B. | 化合物与氧化物属于包含关系 | |
| C. | 电解质与化合物属于交叉关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
分析 应用各知识点的概念,理解概念间相关的关系,结合图示所提供的关系意义,分析相关的选项从而判断正确与否,从物质分类的知识可知物质可分为纯净物与混合物,纯净物又可分为化合物与单质,化合物中又可分为酸碱盐及氧化物,分散系包括溶液、胶体、浊液,化合物分为电解质和非电解质,化学反应依据反应前后是否含有元素化合价变化分为氧化还原反应和非氧化还原反应等.
解答 解:A.溶液和胶体属于分散系中的分类,属于并列关系,故A错误;
B.化合物有多种元素组成,其中氧化物是含有氧元素和另外一种元素的化合物,是包含关系,故B正确;
C.依据化合物在水溶液中和熔融状态下导电情况把化合物分为电解质和非电解质,电解质与化合物属于包含关系,故C错误;
D.有些氧化反应为化合反应,有些化合反应可以是氧化还原反应,二者是交叉关系,故D错误;
故选B.
点评 本题是对概念间关系的考查,把握个概念间的关系是解题的关键所在,此题应属基础知识考查题,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | C-H | C≡C |
| 键能/kJ•mol-1 | a | b | c |
| A. | (b-c-a)kJ•mol-1 | B. | (c+3a-4b)kJ•mol-1 | C. | (6b-c-3a)kJ•mol-1 | D. | (c+3a-6b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Ag+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱 | B. | 同素异形体:活性炭,C60,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:漂白粉,纯净矿泉水,盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
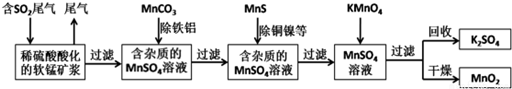
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化和液化都是物理变化,向煤中加入适量CaSO4,可大大减少产物中SO2的量 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM 2.5、二氧化碳都属于空气质量日报的内容 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正反应为放热反应 | |
| B. | 图中P点:v(正)>v(逆) | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.016mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com