
| �¶�/�� | 400 | 500 | 830 | 1 000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| A�� | �÷�Ӧ������Ӧ�����ȷ�Ӧ | |
| B�� | �÷�Ӧ�ﵽƽ���������������������¶ȣ�����Ӧ���ʲ��䣬�����ڻ�������ѹǿ���� | |
| C�� | 830��ʱ���ں��ݷ�Ӧ���а����ʵ�����n��CO����n��H2O����n��H2����n��CO2��=2��4��6��1Ͷ�뷴Ӧ������������Ӧ����ʼʱ�̦��������� | |
| D�� | 830��ʱ����2 L���ܱ������м���4 mol CO��g����6 mol H2O��g���ﵽƽ��ʱ��CO��ת������60% |
���� A���ɱ������ݿ�֪���¶�Խ�ߣ�KԽС���������¶ȣ�ƽ�������ƶ���
B�������¶ȣ�����Ӧ���ʣ�
C�������ʵ�����n��CO����n��H2O����n��H2����n��CO2��=2��4��6��1��Qc=$\frac{6��1}{2��4}$=0.75��K=1.0��ƽ�������ƶ���
D.830��ʱ����2 L���ܱ������м���4 mol CO��g����6 mol H2O��g���ﵽƽ��ʱ����
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ 2 3 0 0
ת�� x x x x
ƽ�� 2-x 3-x x x
$\frac{x��x}{��2-x����3-x��}$=1.0�����x=1.2���Դ������
��� �⣺A���ɱ������ݿ�֪���¶�Խ�ߣ�KԽС���������¶ȣ�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����A����
B�������¶ȣ�����Ӧ���ʣ���ѡ��A��֪��ƽ�������ƶ�����B����
C�������ʵ�����n��CO����n��H2O����n��H2����n��CO2��=2��4��6��1��Qc=$\frac{6��1}{2��4}$=0.75��K=1.0��ƽ�������ƶ������ʼʱ�̦�������������C����
D.830��ʱ����2 L���ܱ������м���4 mol CO��g����6 mol H2O��g���ﵽƽ��ʱ����
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ 2 3 0 0
ת�� x x x x
ƽ�� 2-x 3-x x x
$\frac{x��x}{��2-x����3-x��}$=1.0�����x=1.2����CO��ת������$\frac{1.2mol/L}{2mol/L}$��100%=60%����D��ȷ��
��ѡD��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ձ�����K���¶ȵĹ�ϵ��ƽ���ƶ���ƽ�����η�Ϊ���Ĺؼ������ط�������������Ŀ��飬ע��ѡ��CΪ�����ѵ㣬��Ŀ�ѶȲ���


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
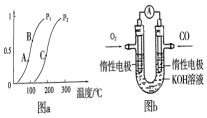 ������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⣮�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
������ʹ�������Դ��չ����̼���á�������Ϊ��ѧ���о�����Ҫ���⣮�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol | B�� | 2mol | C�� | 3mol | D�� | 4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
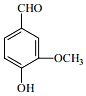 ��������������ɷ��к��е����ȩ����ͼ��Ҳ�������أ�������ʳƷ���Ӽ���ԭ�ϣ������������ã���ش��������⣺
��������������ɷ��к��е����ȩ����ͼ��Ҳ�������أ�������ʳƷ���Ӽ���ԭ�ϣ������������ã���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
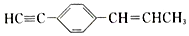 ��˵���в���ȷ���ǣ�������
��˵���в���ȷ���ǣ�������| A�� | ���ֻ��5��̼ԭ����ͬһֱ���� | B�� | �����11��̼ԭ����ͬһƽ���� | ||
| C�� | ��7��̼ԭ�ӿ�����ͬһֱ���� | D�� | �����19��ԭ����ͬһƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 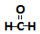 + +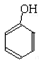 �� ��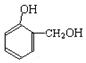 ����ȡ����Ӧ ����ȡ����Ӧ | |
| B�� | ���������Ը��������Һ���𱽺ͼ��� | |
| C�� | �л���C3H8��C6H14һ����ͬϵ�� | |
| D�� | ��ϩ�����п�����8��ԭ�Ӵ���ͬһƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
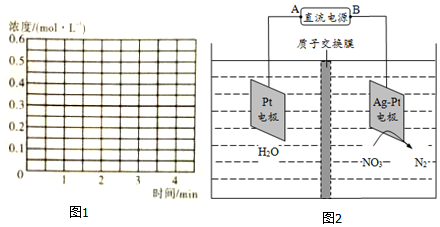
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com