
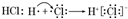
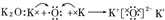
| A. | ①② | B. | ① | C. | ② | D. | 均不正确 |
分析 化学中常在元素符号周围用小黑点“•”或小叉“×”来表示元素原子的最外层电子,相应的式子叫做电子式,用电子式表示化合物形成过程时,应先判定化合物类型,若为离子化合物,则用箭头表示电子的移动,若为共价化合物,则不需要箭头表示.据此分析.
解答 解:①HCl为共价化合物,在由H原子和Cl原子形成HCl的过程中,只有电子对的共用而无电子的得失,故其形成过程不能标箭头,且HCl是由原子过程的,无离子,故形成过程应为 ,故①错误;
,故①错误;
②K2O为离子化合物,2个K原子最外层1个电子被1个O原子得到,用电子式表示K2O的形成过程为: ,故②错误.
,故②错误.
故选D.
点评 本题考查电子式书写和形成过程,难度不大,应判断化学式中原子间的化学键类型,再用电子式写出其形成过程.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示: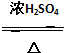 CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: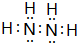 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

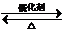
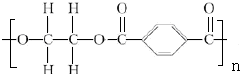 +2nH2O.
+2nH2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;与氨硼烷互为等电子体的有机小分子是CH3CH3 (写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3 (写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加铁的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
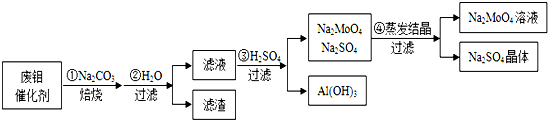
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 146C和167N的质子数相同,中子数不同 | |
| B. | 2814Si和2914Si的质子数相同,是同一种核素 | |
| C. | Na和K属于IA族元索,Na的金属性比K弱 | |
| D. | Cl和Br属于ⅧA族元素,两原子核外电子数之差为8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com