
| A. | 0.9 mol | B. | 0.8 mol | C. | 0.7 mol | D. | 0.6 mol |
分析 反应CO+H2O(g)?CO2+H2达平衡后,加入水蒸气,化学平衡会向着正反应方向进行,但是反应物不可能全部转化为生成物,据此判断.
解答 解:根据题意,利用三段式分析
CO+H2O(g)?CO2 +H2,
初始物质的量:1 1 0 0
变化物质的量:0.6 0.6 0.6 0.6
平衡物质的量:0.4 0.4 0.6 0.6
此时二氧化碳的物质的量是0.6mol,再通入0.3mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.3mol,此时CO2的物质的量0.9mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO2的物质的量介于0.6mol-0.9mol之间,故选BC.
点评 本题考查了化学平衡的计算分析判断,极值方法的计算应用,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①② | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
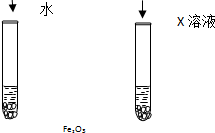 氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:
氧化铁可溶于稀盐酸.某同学想知道是稀盐酸中的哪种粒子(H2O、H+、Cl-)能使氧化铁溶解.设计如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NH4Cl、Mg(NO3)2 | ||
| C. | NH4HCO3、KCl、NaCl | D. | KMnO4、NaCl、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-═Cl-+HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| C. | 石灰水中加入过量小苏打溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32+2H2O | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
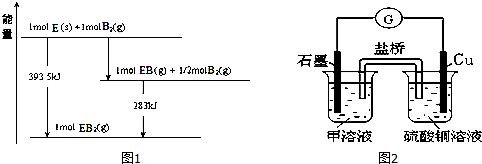
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 对CO(g)+NO2(g)═CO2(g)+NO(g)平衡体系增大压强可使其颜色变深 | |
| C. | 常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5 | |
| D. | 实验室中常用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com