
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 在常温常压下,32 g 18O2中含有2NA个氧原子
B. 100 g 17%的氨水,溶液中含有的NH3分子数为NA
C. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 7.8gNa2O2中阴离子数目为0.1NA
【答案】D
【解析】A、18O2的摩尔质量为36g/mol;B、氨水中存在平衡:NH3+H2ONH3H2O;C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应;D、先计算过氧化钠的物质的量.再计算过氧化微粒数,依据每个过氧化钠化学式中含有阴离子个数计算总离子数。
A、18O2的摩尔质量为36g/mol,故32g18O2的物质的量为![]() mol,则含有的氧原子的个数为
mol,则含有的氧原子的个数为![]() ×2NA个,即
×2NA个,即![]() NA个,选项A错误;B、氨水中存在平衡:NH3+H2ONH3H2O,故溶液中含有的氨气分子个数小于NA个,选项B错误;C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.3NA个,选项C错误;D、7.8克8gNa2O2中含有的物质的量为:n=
NA个,选项A错误;B、氨水中存在平衡:NH3+H2ONH3H2O,故溶液中含有的氨气分子个数小于NA个,选项B错误;C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能反应完全,则转移的电子数小于0.3NA个,选项C错误;D、7.8克8gNa2O2中含有的物质的量为:n=![]() ,一个Na2O2分子中含一个阴离子(O22-),所以阴离子的物质的量是0.1mol,阴离子的数目为:N=n×NA=0.1NA,选项D正确。答案选D。
,一个Na2O2分子中含一个阴离子(O22-),所以阴离子的物质的量是0.1mol,阴离子的数目为:N=n×NA=0.1NA,选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系不正确的是
A. 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜
B. 乙醇能使蛋白质变性,可用75%的乙醇溶液作医疗消毒剂
C. 醋酸酸性强于碳酸,可用醋酸去除水垢
D. 淀粉能与单质碘发生显色反应,可用碘水鉴别淀粉和纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如下:
(1)Ⅱ中含氧官能团的名称 .
(2)反应②的化学方程式 .
(3)下列说法正确的是 .
A.Ⅰ和Ⅴ均属于芳香烃
B.Ⅱ能发生银镜反应
C.Ⅱ能与4molH2发生加成反应
D.反应③属于酯化反应
(4)A的结构简式 .
(5)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种.写出满足上述条件的Ⅵ的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子或离子的基态电子排布式正确的是( )
A. Ni2+:[Ar]3d8 B. Cu:[Ar]3d94s2
C. S2-:[Ne]2s23p6 D. Si:[Ar]3s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中错误的是( )
A. 沉淀中OH-的质量为(n-m)g
B. 恰好溶解后溶液中的NO的物质的量为aVmol
C. 反应过程中转移的电子的物质的量为![]() mol
mol
D. 与合金反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向50mL 0.018mol/L AgNO3溶液中加入50mL 0.02mol/L 盐酸生成沉淀.已知:Ksp(AgCl)=1.8×10﹣10 , 则生成沉淀后的体系中c(Ag+)为( )
A.1.8×10﹣7mol/L
B.1.8×10﹣8 mol/L
C.1.8×10﹣9mol/L
D.1.8×10﹣10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
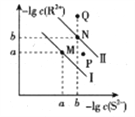
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com