
分析 氧化还原反应中氧化剂氧化性大于其氧化产物,氧化还原反应是顺序反应,还原性强的先和氧化剂反应,
向FeCl3、FeCl2、CuCl2溶液中阳离子氧化剂氧化性Fe3+>Cu2+>Fe2+,金属还原性Fe>Cu;
①若Fe有剩余,Fe3+、Cu2+离子不能存在;
②若容器内还有大量Fe3+,Fe、Cu不能存在;
③若容器内有较多Cu2+和Cu,Fe3+,Fe不能存在;
解答 解:氯气与氯化亚铁溶液反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-,氧化剂Cl2氧化性大于Fe3+,氯化铁溶液与碘化钾溶液反应的离子方程式是2Fe3++2I一=2Fe2++I2,氧化剂Fe3+的氧化性大于I2,氧则Fe3+、Cl2、I2的氧化性由强到弱的顺序是Cl2>Fe3+>I2,若将氯气通入物质的量浓度相同的氯化亚铁、碘化钾的混合溶液中离子还原性I->Fe2+,则先被氧化的离子是I-,
向FeCl3、FeCl2、CuCl2溶液加入单质Fe,溶液中阳离子氧化剂氧化性Fe3+>Cu2+>Fe2+,金属还原性Fe>Cu,
故答案为:Cl2>Fe3+>I2;I-;
①充分反应后,若Fe有剩余,Fe3+、Cu2+离子不能存在,则容器内不可能有Fe3+、Cu2+,故答案为:Fe3+、Cu2+;
②若容器内还有大量Fe3+,Fe、Cu不能存在,则容器内还含有Cu2+、Fe2+,一定没有Fe,故答案为:Cu2+、Fe2+;Fe;
③若容器内有较多Cu2+和Cu,则容器内不可能有Fe3+,Fe,故答案为:Fe3+、Fe;
点评 本题考查氧化还原反应及应用,为高频考点,把握还原性强弱、氧化性强弱判断发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 9.2g甲苯中含有的C-H键的数目为0.8NA | |
| B. | 0.1 mol乙醛中含有的碳碳双键的数目为0.1NA | |
| C. | 1 mol羧基(-COOH>中含★的电子总数为22NA | |
| D. | 标准状况下,2.24 L乙醇完全燃烧生成的H20分子数目约为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
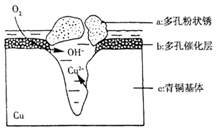 如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.
如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:l | B. | 1:3 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、Na+、SO42-、OH- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | 漂白粉溶液中:H+、Na+、I-、Cl- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
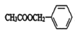 )存在于可可、咖啡、草莓等食品中,常用作食品香精.请回答下列问题:
)存在于可可、咖啡、草莓等食品中,常用作食品香精.请回答下列问题: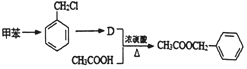
 的反应条件为光照
的反应条件为光照 生成D的反应化学方程式为
生成D的反应化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱性废水中和处理酸性废水 | |
| B. | 将工业废液排入海洋以减少河道污染 | |
| C. | 生活污水无害化处理后用于绿化灌溉 | |
| D. | 推广使用高效、低毒农药,减轻水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.02 mol/(L•s) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v(C)=0.5 mol/(L•min) | D. | v(D)=0.01 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com