
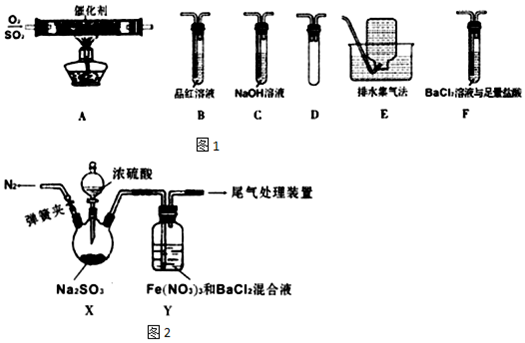
| 实验步骤 | 现象和结论 |
| ①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的稀硝酸与BaCl2的混合液,并通入适量N2; ③将SO2通入步骤②中溶液. | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立. |
分析 【实验I】A中SO2催化氧化生成SO3,反应为:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3,为防止倒吸,连接D装置,SO2与氯化钡不反应,SO3与氯化钡反应生成不溶于酸的白色沉淀,连接F装置中氯化钡和盐酸的混合溶液可检验SO3,SO2有漂白性,通入B装置中的品红溶液可检验SO2,SO2、SO3均为酸性氧化物,溶于氢氧化钠,故连接C装置充分吸收SO2、SO3气体,最后连接E装置利用氧气不溶于水的性质收集氧气,B中品红溶液褪色,说明有SO2,F中有白色沉淀生成,说明有SO3,E中集气瓶中有气体说明有氧气生成,据此分析解答;
【实验II】(4)X中由亚硫酸钠与浓硫酸制备二氧化硫,为防止空气中的氧气干扰,先通入氮气排尽装置中的空气;
(5)装置Y中的白色沉淀为硫酸钡;Fe3+具有氧化性,酸性条件下NO3-也具有强氧化性;
(6)按假设1,在酸性条件下SO2与NO3-反应,等pH稀硝酸与氯化钡的混合溶液与二氧化硫反应,据此分析.
解答 解:【实验I】(1)A模拟工业生产中SO2催化氧化的反应,其化学方程式为:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;
故答案为:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;
(2)根据气体的性质,SO2与氯化钡不反应,SO3与氯化钡反应生成不溶于酸的白色沉淀,连接F装置中氯化钡和盐酸的混合溶液可检验SO3,SO2有漂白性,通入B装置中的品红溶液可检验SO2,SO2、SO3均为酸性氧化物,溶于氢氧化钠,故连接C装置充分吸收SO2、SO3气体,最后连接E装置利用氧气不溶于水的性质收集氧气,为防止倒吸,A之后应连接装置D,故连接顺序为:DFBCE;
故答案为:DFBCE;
(3)B中品红溶液褪色,说明有SO2,F中有白色沉淀生成,说明有SO3;
故答案为:B中品红溶液褪色;F中有白色沉淀;
(4)X中由亚硫酸钠与浓硫酸制备二氧化硫,为防止空气中的氧气干扰,先通入氮气排尽装置中的空气;
故答案为:排尽装置内的空气,排除O2的干扰;
(5)装置Y中的白色沉淀为硫酸钡;Fe3+具有氧化性,酸性条件下NO3-也具有强氧化性,故可能为在酸性条件下SO2与NO3-反应、SO2与Fe3+反应、SO2与Fe3+、NO3-都反应;
故答案为:BaSO4;SO2与Fe3+、NO3-都反应;
(6)按假设1,在酸性条件下SO2与NO3-反应,则选择与Y装置等pH的稀硝酸与氯化钡的混合溶液与二氧化硫反应,若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立;
假设1成立,则反应的离子方程式为:4SO2+NO3-+5H2O+4Ba2+═4BaSO4↓+NH4++6H+;
故答案为:稀硝酸与BaCl2的混合液;4SO2+NO3-+5H2O+4Ba2+═4BaSO4↓+NH4++6H+.
点评 本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发 | |
| B. | 蒸馏操作中冷凝管的冷却水应下进上出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 浓硫酸的稀释可以在量筒中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2的溶解度最小 | |
| B. | Ca(OH)2的溶解度最小 | |
| C. | AgCl的溶解度最小 | |
| D. | 同一温度下Ksp越大的溶解度也越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是非金属氧化物 | |
| B. | 都是酸性氧化物,都能与强碱溶液反应 | |
| C. | 都能溶于水且与水反应生成相应的酸 | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验操作 | 现象或结论 |
| ① | 测饱和NaHCO3溶液的pH | pH为8.3 |
| ② | 向2mL Na2CO3溶液中加入MgCl2溶液 | 有白色沉淀生成 |
| ③ | 向2mL饱和NaHCO3溶液中加入MgCl2溶液 | 无明显现象 |
| ④ | 向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时 | 溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
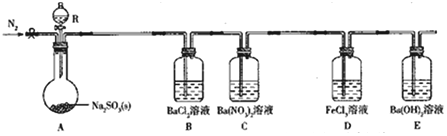
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
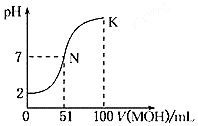 常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )
常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计).下列说法中正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | HA的电离方程式为:HA?H++A- | |
| C. | K点溶液中:c (MOH)+c(OH-)-c(H+)=0.01mol•L-1 | |
| D. | N点水的电离程度大于K点水的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com