
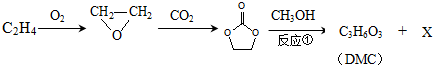
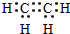 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解

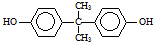 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: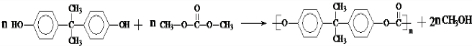 .
. 分析 (1)乙烯分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对;石油工业上通过石油裂解获得C2H4;
(2)由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC( )和X(HOCH2CH2OH);
)和X(HOCH2CH2OH);
(3)A.X结构简式为HOCH2CH2OH;
B.X含有2个-OH,甘油含有3个-OH;
C.X为乙二醇,能发生氧化、取代、缩聚等反应,不能发生还原反应;
D.羟基与钠反应生成氢气,生成的氢气不一定处于标况下;
(4)Y与DMC互为同分异构体,Y的水溶液呈酸性,含有羧基,在一定条件下2mol Y能生成1mol分子中含六元环结构的有机物Z,应是发生酯化反应,则Y中-COOH与-OH连接同一碳原子;
(5)根据反应①可知,DMC与双酚( )反应生成
)反应生成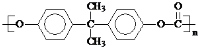 与CH3OH.
与CH3OH.
解答 解:(1)乙烯分子中碳原子之间形成2对共用电子对,碳原子与氢原子之间形成1对共用电子对,电子式为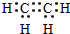 ;石油工业上通过石油裂解获得C2H4,
;石油工业上通过石油裂解获得C2H4,
故答案为: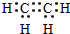 ;石油裂解;
;石油裂解;
(2)由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC( )和X(HOCH2CH2OH),
)和X(HOCH2CH2OH),
故答案为:加成反应; ;
;
(3)A.X结构简式为HOCH2CH2OH,分子式为C2H6O2,故A正确;
B.X含有2个-OH,甘油含有3个-OH,X与甘油不是同分异构体,故B错误;
C.X为乙二醇,能发生氧化、取代、缩聚等反应,不能发生还原反应,故C错误;
D.羟基与钠反应生成氢气,1molX与足量的反应生成1mol氢气,但氢气不一定处于标况下,其体积不一定为22.4L,故D错误,
故选:A;
(4)Y与DMC互为同分异构体,Y的水溶液呈酸性,含有羧基,在一定条件下2mol Y能生成1mol分子中含六元环结构的有机物Z,应是发生酯化反应,则Y中-COOH与-OH连接同一碳原子,则Y的结构简式为:
故答案为:
(5)根据反应①可知,DMC与双酚( )反应生成
)反应生成 与CH3OH,反应方程式为:
与CH3OH,反应方程式为: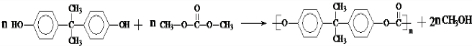 ,
,
故答案为: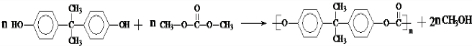 .
.
点评 本题考查有机物合成与推断、官能团结构与性质、有机反应类型等,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,易错点为(5),注意理解转化中反应信息.


科目:高中化学 来源: 题型:解答题
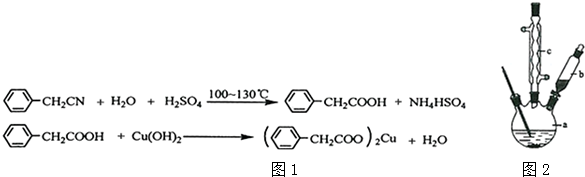
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.
春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com