
| A. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| C. | 铝与硫酸铜溶液反应:Al+Cu2+═Al3++Cu | |
| D. | 氯化钡溶液与稀硫酸反应:SO42-+Ba2+═BaSO4↓ |
分析 A.二者反应生成氯化亚铁和氢气;
B.二者发生酸碱中和反应,实质氢离子与氢氧根离子反应生成水;
C.电荷不守恒;
D.二者反应生成硫酸钡和氯化氢.
解答 解:A.铁与稀盐酸反应,离子方程式:Fe+2H+═Fe2++H2↑,故A正确;
B.氢氧化钠溶液与盐酸反应,离子方程式:OH-+H+═H2O,故B正确;
C.铝与硫酸铜溶液反应,离子方程式:2Al+3Cu2+═2Al3++3Cu,故C错误;
D.氯化钡溶液与稀硫酸反应,离子方程式:SO42-+Ba2+═BaSO4↓,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式拆分,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
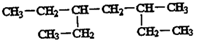 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )| A. | 该有机物属于烷烃 | |
| B. | 该有机物与3-甲基-5-乙基辛烷互为同系物 | |
| C. | 该有机物与2,5-二甲基一3-乙基己烷互为同分异构体 | |
| D. | 该有机物命名时,主链上的碳原子数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
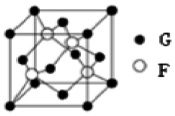 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子化合物中可能含有共价键 | |
| B. | 阴、阳离子间通过静电作用所形成的化学键是离子键 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 需要加热的化学反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 灼烧白色粉末,火焰呈黄色 | 证明原粉末中有Na+,无K+ |
| B | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 证明该Fe(NO3)2试样已经变质 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 证明溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: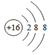 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为7 的碳原子:${\;}_{6}^{7}$C | D. | CO2 的电子式: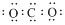 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
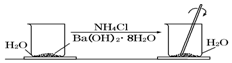 在研究化学反应中的能量变化时,我们通常做下面的实验:
在研究化学反应中的能量变化时,我们通常做下面的实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
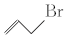 .则关于有机物
.则关于有机物  的说法正确的有( )
的说法正确的有( )| A. | 与苯互为同分异构体 | B. | 其二氯代物有3种 (不考虑立体异构) | ||
| C. | 分子中所有的碳原子在同一平面上 | D. | 属于烯烃,是乙烯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图:
酚酞是白色结晶,在空气中稳定,几乎不溶于水,常用做酸碱指示剂,其结构简式如图: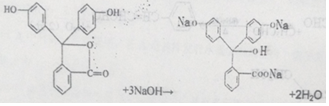 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com