
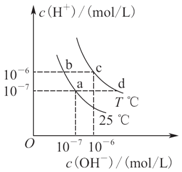
| A. | a点对应的溶液和c点对应的溶液pH大小:pH(c)>pH(a) | |
| B. | 如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:c(HA-)>c(H2A)>c(H+)>c(A2-) | |
| C. | 25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1 mol/L的NaF溶液与0.1 mol/L的CH3COOK溶液相比: c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | d点对应的溶液中可大量存在:K+、Ba2+、NO3-、I- |
分析 A、pH=-lgc(H+);
B、b点对应的溶液显酸性,若溶液中只含NaHA,则说明HA-的电离大于HA-的水解;
C、25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,则说明酸性HF>CH3COOH,则等浓度时F-的水解能力弱于CH3COO-;
D、d点溶液显碱性,据此分析.
解答 解:A、根据图示可知,a点溶液中c(H+)=10-7mol/L,c点溶液中c(H+)=10-6mol/L,而根据pH=-lgc(H+)可知,pH(c)=6<pH(a)=7,故A错误;
B、b点对应的溶液显酸性,若溶液中只含NaHA,则说明HA-的电离程度HA-?H++A2-大于HA-的水解H2O+HA-?H2A+OH-,故有:c(HA-)>c(A2-)>c(H2A)>c(H+),故B错误;
C、25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,则说明酸性HF>CH3COOH,则等浓度时F-的水解能力弱于CH3COO-,故0.1 mol/L的NaF溶液与0.1 mol/L的CH3COOK溶液中,c(Na+)=c(K+),且c(F-)>c(CH3COO-),则c(Na+)-c(F-)<c(K+)-c(CH3COO-),故C错误;
D、d点溶液显碱性,而K+、Ba2+、NO3-、I-在碱性溶液中均能大量共存,故D正确.
故选D.
点评 本题考查了水的电离,离子积的概念应用和影响条件分析,离子积是随温度变化的量,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-=2AlO2-+H2↑ | |
| B. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| C. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚在正极,发生氧化反应 | |
| B. | O2在负极,发生还原反应 | |
| C. | 反应结束后,电解液的酸度可能略有增加 | |
| D. | 正极的电极反应是C6H6O+11H2O-28e-═6CO2+28H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
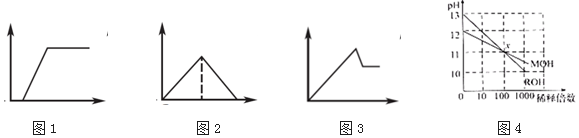
| A. | 图1:往Na2CO3和NaOH混合液中逐滴加入盐酸,产生气体体积与盐酸的物质的量的关系 | |
| B. | 图2:往澄清石灰水中通入过量CO2气体,产生沉淀质量与CO2的物质的量的关系 | |
| C. | 图3:往AlCl3和MgCl2混合液中逐滴加入NaOH溶液,产生沉淀质量与NaOH溶液的物质的量的关系 | |
| D. | 图4:若MOH和ROH表示两种一元碱,则ROH的碱性强于MOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②④①③ | B. | ④②⑤①③ | C. | ②⑤④①③ | D. | ⑤④②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16gO3所含的氧原子数目为NA | |
| B. | 标准状况下,22.4L H2O所含分子数目为NA | |
| C. | 24gMg变成Mg2+时失去的电子数目为NA | |
| D. | 1 L 1mol/L的FeCl3溶液中含有Cl-的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com